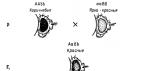
Степень окисления
О наглядности условного заряда
Каждому учителю известно, как много значит первый год изучения химии. Будет ли она понятной, интересной, важной в жизни и при выборе профессии? Многое зависит от умения учителя доступно и наглядно ответить на «простые» вопросы учащихся.
Один из таких вопросов: «Откуда берутся формулы веществ?» – требует знания понятия «степень окисления».
Формулировка понятия «степень окисления» как
«условного заряда атомов химических элементов в
соединении, вычисленного на основе
предположения, что все соединения (и ионные, и
ковалентно-полярные) состоят только из ионов»
(см.: Габриелян О.С.
Химия-8. М.: Дрофа, 2002,
с. 61) доступна немногим учащимся, понимающим
природу образования химической связи между
атомами. Большинству запомнить это определение
трудно, его нужно зубрить. А для чего?
Определение – шаг в познании и становится инструментом для работы, когда оно не заучено, а запомнилось, потому что понятно.
В начале изучения нового предмета важно наглядно проиллюстрировать абстрактные понятия, которых особенно много в курсе химии 8-го класса. Именно такой подход я и хочу предложить, причем сформировать понятие «степень окисления» до изучения разновидностей химической связи и как основу для понимания механизма ее образования.
С первых уроков восьмиклассники учатся применять периодическую систему химических элементов как справочную таблицу для составления схем строения атомов и определения их свойств по числу валентных электронов. Приступая к формированию понятия «степень окисления», я провожу два урока.
Урок 1.
Почему атомы неметаллов
соединяются друг с другом?
Давайте пофантазируем. Как выглядел бы мир, если бы атомы не соединялись, не было бы молекул, кристаллов и более крупных образований? Ответ поражает: мир был бы невидим. Мира физических тел, одушевленных и неодушевленных, просто бы не было!
Далее обсуждаем, все ли атомы химических элементов соединяются. Нет ли в природе одиночных атомов? Оказывается, есть – это атомы благородных (инертных) газов. Сравниваем электронное строение атомов благородных газов, выясняем особенность завершенных и устойчивых внешних энергетических уровней:
Выражение «внешние энергетические уровни завершены и устойчивы» означает, что эти уровни содержат максимальное число электронов (у атома гелия – 2e , у атомов других благородных газов – 8e ).
Чем объяснить устойчивость внешнего восьмиэлектронного уровня? В периодической системе восемь групп элементов, значит, максимальное число валентных электронов равно восьми. Атомы благородных газов одиночные потому, что имеют максимальное число электронов на внешнем энергетическом уровне. Они не образуют ни молекул, как Cl 2 и Р 4 , ни кристаллических решеток, как графит и алмаз. Тогда можно предположить, что атомы остальных химических элементов стремятся принять оболочку благородного газа – восемь электронов на внешнем энергетическом уровне, – соединяясь друг с другом.
Проверим это предположение на примере образования молекулы воды (формула Н 2 О известна учащимся, как и то, что вода – главное вещество планеты и жизни). Почему формула воды Н 2 О?
Используя схемы атомов, учащиеся догадываются, почему выгодно соединение двух атомов Н и одного атома О в молекулу. В результате смещения одиночных электронов от двух атомов водорода у атома кислорода на внешнем энергетическом уровне помещается восемь электронов. Учащиеся предлагают разные способы взаимного расположения атомов. Выбираем симметричный вариант, подчеркивая, что природа живет по законам красоты и гармонии:

Соединение атомов ведет к утрате их электронейтральности, хотя молекула в целом электронейтральна:

Возникший заряд определяется как условный, т.к. он «скрыт» внутри электронейтральной молекулы.
Формируем понятие «электроотрицательность»: атом кислорода имеет условный отрицательный заряд –2, т.к. он сместил к себе два электрона от атомов водорода. Значит, кислород электроотрицательнее водорода.
Записываем: электроотрицательность (ЭО) – свойство атомов смещать к себе валентные электроны от других атомов. Работаем с рядом электроотрицательности неметаллов. Используя периодическую систему, объясняем наибольшую электроотрицательность фтора.
Объединяя все вышесказанное, формулируем и записываем определение степени окисления.
Степень окисления – условный заряд атомов в соединении, равный числу электронов, смещенных к атомам с большей электроотрицательностью.
Можно пояснить и термин «окисление» как отдачу электронов атомам более электроотрицательного элемента, подчеркнув, что при соединении атомов разных неметаллов чаще происходит лишь смещение электронов к более электроотрицательному неметаллу. Таким образом, электроотрицательность – свойство атомов неметаллов, что и отражено в названии «Ряд электроотрицательности неметаллов».
Согласно закону постоянства состава веществ, открытому французским ученым Жозефом Луи Прустом в 1799–1806 гг., каждое химически чистое вещество, независимо от места нахождения и способа получения, имеет один и тот же постоянный состав. Значит, если на Марсе есть вода, то она будет той же самой «аш-два-о»!
В качестве закрепления материала проверяем «правильность» формулы углекислого газа, составляя схему образования молекулы СО 2:

Соединяются атомы с разной электроотрицательностью: углерод (ЭО = 2,5) и кислород (ЭО = 3,5). Валентные электроны (4е ) атома углерода смещаются к двум атомам кислорода (2е – к одному атому О и 2е – к другому атому О). Следовательно, степень окисления углерода +4, а степень окисления кислорода –2.
Соединяясь, атомы завершают, делают устойчивым свой внешний энергетический уровень (дополняют его до 8е ). Вот почему атомы всех элементов, кроме благородных газов, соединяются друг с другом. Атомы благородных газов одиночные, их формулы записывают знаком химического элемента: Не, Nе, Аr и т. д.
Степень окисления атомов благородных газов, как и всех атомов в свободном состоянии, равна нулю:
Это и понятно, т.к. атомы электронейтральны.
Степень окисления атомов в молекулах простых веществ также равна нулю:
![]()
При соединении атомов одного элемента никакого смещения электронов не происходит, т.к. их электроотрицательность одинакова.
Использую прием парадокса: как дополняют свой внешний энергетический уровень до восьми электронов атомы неметаллов в составе двухатомных молекул газов, например, хлора? Схематически представим вопрос так:

Смещения валентных электронов (е ) не происходит, т.к. электроотрицательность обоих атомов хлора одинакова.
Этот вопрос ставит учащихся в тупик.
В качестве подсказки предлагается рассмотреть более простой пример – образование двухатомной молекулы водорода.
Учащиеся быстро догадываются: раз смещение электронов невозможно, атомы могут объединить свои электроны. Схема такого процесса следующая:

Валентные электроны становятся общими, соединяя атомы в молекулу, при этом внешний энергетический уровень обоих атомов водорода становится завершенным.
Предлагаю изобразить валентные электроны точками. Тогда общую пару электронов следует расположить на оси симметрии между атомами, т.к. при соединении атомов одного химического элемента смещения электронов не происходит. Следовательно, степень окисления атомов водорода в молекуле равна нулю:

Так закладывается основа для изучения в дальнейшем ковалентной связи.
Возвращаемся к образованию двухатомной молекулы хлора. Кто-то из учащихся догадывается предложить следующую схему соединения атомов хлора в молекулу:

Обращаю внимание учащихся, что общую пару электронов, соединяющую атомы хлора в молекулу, образуют только неспаренные валентные электроны.
Так учащиеся могут делать свои открытия, радость от которых не только надолго запоминается, но и развивает творческие способности, личность в целом.
На дом учащиеся получают задание: изобразить схемы образования общих электронных пар в молекулах фтора F 2 , хлороводорода НСl, кислорода O 2 и определить степени окисления в них атомов.
В домашнем задании надо суметь отойти от шаблона. Так, при составлении схемы образования молекулы кислорода учащимся надо изобразить не одну, а две общие пары электронов на оси симметрии между атомами:

В схеме образования молекулы хлороводорода следует показать смещение общей пары электронов к более электроотрицательному атому хлора:
В соединении HCl степени окисления атомов: Н – +1 и Cl – –1.
Таким образом, определение степени окисления как условного заряда атомов в молекуле, равное числу электронов, смещенных к атомам с большей электроотрицательностью, дает возможность не только сформулировать это понятие наглядно и доступно, но и сделать его основой для понимания природы химической связи.
Работая по принципу «сначала понять, а потом запомнить», применяя прием парадокса и создавая на уроках проблемные ситуации, можно получить не только хорошие результаты обучения, но и добиться понимания даже самых сложных абстрактных понятий и определений.
Урок 2.
Соединение атомов металлов
с неметаллами
При проверке домашнего задания предлагаю учащимся сравнить два варианта наглядного изображения соединения атомов в молекулу.
Варианты изображения образования молекул
М о л е к у л а ф т о р а F 2
Вариант 1.
![]()
Соединяются атомы одного химического элемента.
Электроотрицательность атомов одинакова.
Смещения валентных электронов не происходит.
Как образуется молекула фтора F 2 – н е я с н о.
Вариант 2.
Спаривание валентных электронов одинаковых
атомов
Изображаем валентные электроны атомов фтора точками:
![]()
Неспаренные валентные электроны атомов фтора образовали общую пару электронов, изображаемую в схеме молекулы на оси симметрии. Поскольку смещения валентных электронов не происходит, степень окисления атомов фтора в молекуле F 2 равна нулю.
Результатом соединения атомов фтора в молекулу при помощи общей пары электронов стал завершенный внешний восьмиэлектронный уровень обоих атомов фтора.
Подобным образом рассматривается образование молекулы кислорода О 2 .
М о л е к у л а к и с л о р о д а О 2
Вариант 1.
Использование схем строения атомов
![]()
Вариант 2.
Cпаривание валентных электронов одинаковых
атомов

М о л е к у л а х л о р о в о д о р о д а HCl
Вариант 1.
Использование схем строения атомов
Более электроотрицательный атом хлора сместил к себе один валентный электрон от атома водорода. На атомах возникли условные заряды: степень окисления атома водорода +1, степень окисления атома хлора –1.
В результате соединения атомов в молекулу НСl атом водорода «утратил» (по схеме) свой валентный электрон, а атом хлора достроил свой внешний энергетический уровень до восьми электронов.
Вариант 2.
Спаривание валентных электронов разных атомов
![]()
Неспаренные валентные электроны атомов водорода и хлора образовали общую пару электронов, смещенную к более электроотрицательному атому хлора. В результате на атомах образовались условные заряды: степень окисления атома водорода +1, степень окисления атома хлора –1.
При соединении атомов в молекулу с помощью общей пары электронов их внешние энергетические уровни становятся завершенными. У атома водорода внешний уровень становится двухэлектронным, но смещенным к более электроотрицательному атому хлора, а у атома хлора – устойчивым восьмиэлектронным.
Остановимся подробнее на последнем примере – образовании молекулы НСl. Какая схема точнее и почему? Учащиеся подмечают существенное различие. Использование схем атомов при образовании молекулы НСl предполагает смещение валентного электрона от атома водорода к более электроотрицательному атому хлора.
Напоминаю, что электроотрицательность (свойство атомов смещать к себе валентные электроны от других атомов) в разной степени присуща всем элементам.
Учащиеся приходят к выводу, что использование схем атомов при образовании HCl не дает возможности показать смещение электронов к более электроотрицательному элементу. Изображение валентных электронов точками более точно объясняет образование молекулы хлороводорода. При связывании атомов H и Сl присходит смещение (на схеме – отклонение от оси симметрии) валентного электрона атома водорода к более электроотрицательному атому хлора. Как следствие, оба атома приобретают определенную степень окисления. Неспаренные валентные электроны не только образовали общую пару электронов, соединившую атомы в молекулу, но и достроили внешние энергетические уровни обоих атомов. Схемы образования молекул F 2 и О 2 из атомов также более понятны при изображении валентных электронов точками.
По примеру предыдущего урока с его главным вопросом «Откуда берутся формулы веществ?» учащимся предлагается ответить на вопрос: «Почему у поваренной соли формула NaCl?»
О б р а з о в а н и е х л о р и д а н а т р и я NaCl
Учащиеся составляют следующую схему:
Проговариваем: натрий – элемент Ia подгруппы, имеет один валентный электрон, следовательно, он – металл; хлор – элемент VIIа подгруппы, имеет семь валентных электронов, следовательно, он – неметалл; в хлориде натрия валентный электрон атома натрия будет смещен к атому хлора.
Спрашиваю ребят: а все ли в этой схеме верно? Каков результат соединения атомов натрия и хлора в молекулу NaCl?
Учащиеся отвечают: результатом соединения атомов в молекулу NaCl стало образование устойчивого восьмиэлектронного внешнего уровня атома хлора и двухэлектронного внешнего уровня атома натрия. Парадокс: два валентных электрона на внешнем третьем энергетическом уровне атому натрия ни к чему! (Работаем со схемой атома натрия.)
Значит, атому натрия «невыгодно» соединяться с атомом хлора, и соединения NaCl не должно быть в природе. Однако учащимся известно из курсов географии и биологии о распространенности поваренной соли на планете и ее роли в жизни живых организмов.
Как найти выход из сложившейся парадоксальной ситуации?
Работаем со схемами атомов натрия и хлора, и учащиеся догадываются, что атому натрия выгодно не сместить, а отдать свой валентный электрон атому хлора. Тогда у атома натрия будет завершен второй снаружи – предвнешний – энергетический уровень. У атома хлора внешний энергетический уровень также станет восьмиэлектронным:
Приходим к выводу: атомам металла, имеющим малое число валентных электронов, выгодно отдавать, а не смещать свои валентные электроны к атомам неметалла. Следовательно, атомы металлов электроотрицательностью не обладают.
Предлагаю ввести «знак захвата» чужого валентного электрона атомом неметалла – квадратную скобку.
При изображении валентных электронов точками схема соединения атомов металла и неметалла будет выглядеть так:
Обращаю внимание учащихся, что при переносе валентного электрона от атома металла (натрия) к атому неметалла (хлору) атомы превращаются в ионы.
Ионы – заряженные частицы, в которые превращаются атомы в результате передачи или присоединения электронов.
Знаки и величины зарядов ионов и степеней окисления совпадают, а отличие в оформлении следующее:
1 –1
Na, Cl – для степеней окисления,
Na + , Cl – – для зарядов ионов.
О б р а з о в а н и е ф т о р и д а к а л ь ц и я CaF 2
Кальций – элемент IIа подгруппы, он имеет два валентных электрона, это – металл. Атом кальция отдает свои валентные электроны атому фтора – неметаллу, самому электроотрицательному элементу.
В схеме располагаем неспаренные валентные электроны атомов так, чтобы они «увидели» друг друга и смогли образовать электронные пары:
Связывание атомов кальция и фтора в соединение CaF 2 энергетически выгодно. В результате у обоих атомов энергетический уровень становится восьмиэлектронным: у фтора – это внешний энергетический уровень, а у кальция – предвнешний. Схематическое изображение переноса электронов в атомах (пригодится при изучении окислительно-восстановительных реакций):

Обращаю внимание учащихся, что, подобно притяжению отрицательно заряженных электронов к положительно заряженному ядру атома, противоположно заряженные ионы удерживаются силой электростатического притяжения.
Ионные соединения – это твердые вещества с
высокой температурой плавления. Из жизни
учащимся известно: можно несколько часов
безрезультатно прокаливать поваренную соль.
Температуры пламени газовой горелки (~500 °C)
недостаточно, чтобы расплавить соль
(t
пл (NaCl) = 800 °C). Отсюда делаем вывод:
связь между заряженными частицами (ионами) –
ионная связь – очень прочная.
Обобщаем: при соединении атомов металла (М) с атомами неметалла (Нем) происходит не смещение, а отдача валентных электронов атомами металла атомам неметалла.
При этом электронейтральные атомы превращаются в заряженные частицы – ионы, заряд которых совпадает с числом отданных (у металла) и присоединенных (у неметалла) электронов.
Таким образом, на первом из двух уроков формируется понятие «степень окисления», а на втором объясняется образование ионного соединения. Новые понятия послужат хорошей основой для дальнейшего изучения теоретического материала, а именно: механизмов образования химической связи, зависимости свойств веществ от их состава и строения, рассмотрения окислительно-восстановительных реакций.
В заключение хочу сравнить два методических приема: прием парадокса и прием создания проблемных ситуаций на уроке.
Парадоксальная ситуация создается логически в ходе изучения нового материала. Ее главный плюс – сильные эмоции, удивление учащихся. Удивление – мощный толчок мышлению вообще. Оно «включает» непроизвольное внимание, активизирует мышление, заставляет исследовать и находить пути решения возникшего вопроса.
Коллеги, наверное, возразят: создание проблемной ситуации на уроке приводит к тому же. Приводит, да не всегда! Как правило, проблемный вопрос формулируется учителем перед изучением нового материала и стимулирует к работе далеко не всех учащихся. Многим остается непонятным, откуда эта проблема взялась и почему, собственно, она нуждается в решении. Прием парадокса создается в ходе изучения нового материала, побуждает учащихся самих сформулировать проблему, а значит, понимать истоки ее возникновения и необходимость решения.
Осмелюсь утверждать, что прием парадокса является наиболее успешным способом активизации деятельности учащихся на уроках, развития у них навыков исследовательской работы и творческих способностей.
Идея о том, что кажущаяся неделимой материя состоит из мельчайших, невидимых глазу частиц, была выдвинута древнегреческим философом Демокритом ещё в V в. до нашей эры. Демокрит считал, что атомы – вечные, неизменные частицы. Доказать своё утверждение Демокрит не мог. Эта теория так и оставалась всего лишь предположением вплоть до начала XIX в., когда химия начала формироваться как наука.
Слово «атом» происходит от греческого «атомос», что означает «неделимый».
Что такое атом

Джон Дальтон
Химиками было обнаружено, что в процессе химических реакций многие вещества распадаются на более простые вещества. Так, вода распадается на кислород и водород. Оксид ртути распадается на ртуть и кислород. Но кислород, ртуть и водород уже невозможно разложить на более простые вещества с помощью химических реакций. Такие вещества были названы химическими элементами .
В 1808 г. английский физик и химик Джон Дальтон опубликовал свой документальный труд «Новая система химической философии». Дальтон предположил, что каждый химический элемент имеет атом, отличный от атомов других элементов. И в химических реакциях эти атомы объединяются или смешиваются в разных пропорциях. В результате образуются химические вещества. Так, в состав воды входят два атома водорода и один атом кислорода. И при любой химической реакции водород и кислород всё равно будут в составе воды в соотношении 2:1. Дальтон считал, что атомы неделимы. И даже сейчас, когда мы знаем, что атом состоит из положительно заряженного ядра и вращающихся по орбитам около него отрицательно заряженных электронов, мы согласны с Дальтоном в том, что каждому химическому элементу соответствует свой особый тип атома.
Строение атома

Атом
Атом – наименьшая частица вещества, которая является носителем его свойств. Это также и наименьшее количество химического элемента, которое содержится в молекулах. Состоит атом из ядра и электронной оболочки. В состав ядра входят протоны и нейтроны. А электронная оболочка состоит из электронов. Атомы разных веществ отличаются размерами, массой и свойствами.
Объединяясь, атомы образуют молекулы. Молекула – наименьшая частица вещества, способная существовать самостоятельно и обладающая всеми его химическими свойствами. В составе молекулы могут быть атомы одного или различных химических элементов. Если молекула вещества состоит из атома только одного вещества, то понятия атом и молекула для неё совпадают. Атомы объединяются межатомными или химическими связями .
Согласно атомной теории, каждый атом – это центр химической соединяемости. Он может соединяться с одним или несколькими атомами другого вещества.
А все химические вещества разделяют на простые и сложные.
Простое химическое вещество состоит из атомов только одного элемента и не распадается на более простые вещества при обычной химической реакции. Простое вещество может иметь атомное строение, то есть оно состоит из одиночных атомов. Примеры таких веществ – газы аргон Ar и гелий He.
Сложное химическое вещество состоит из атомов двух и более химических элементов. Эти элементы во время химических реакций могут превращаться в другие вещества или разлагаться на простые элементы.
Химические атомные связи
Молекула
Химические связи между атомами бывают металлические, ковалентные и ионные.
В электронной оболочке атома столько электронов, сколько протонов в ядре, так как в целом атом нейтрален. Все электроны движутся по орбитам вокруг ядра подобно тому, как планеты движутся вокруг Солнца.
В молекуле с ионной химической связью электроны одного химического элемента отдают свои электроны, а атомы другого элемента их принимают. И тогда первый атом превращается в ион, имеющий положительный заряд. А атом другого химического элемента приобретает дополнительные электроны и становится отрицательно заряженным ионом. Ионная связь в молекуле возникает в том случае, когда атомы элементов сильно отличаются в размерах.
В случае, если атомы имеют маленький размер и примерно одинаковые радиусы, у них могут образовываться общие пары электронов. Такая связь называется ковалентной . В свою очередь, ковалентная связь бывает неполярная и полярная . Неполярная связь возникает между одинаковыми атомами, а полярная – между разными.
Чтобы понять, что такое металлическая атомная связь, необходимо познакомиться с понятием «валентность».
Валентностью называют способность атома одного элемента присоединять один или несколько атомов другого элемента. За единицу валентности принята соединяемость атома водорода, так как атом водорода способен присоединить к себе только один атом другого элемента. Считается, что водород одновалентен. Одновалентными считаются также все химические элементы, которые способны присоединить к себе только один атом водорода. Если элемент может присоединить к себе два атома водорода, то его валентность равна 2. И так далее. Кислород – двухвалентный химический элемент. Обычно валентность элемента равна количеству электронов на внешней орбите атома. Эти электроны и называются валентными.
Так вот, металлическая связь образуется, когда валентные электроны связываемых атомов металлического кристалла образуют единое электронное облако. Это облако можно легко смещать действием электрического напряжения. Это и объясняет, почему металлы так хорошо проводят электрический ток.
Верная рука – друг индейцев, не так ли? В скором времени и у нас появятся руки-друзья. Разработка механических конечностей идёт полным ходом, но какие-то они пока левые. Однако в будущем руки-роботы смогут претендовать и на звание «правой руки». Когда их доведут до ума и подключат к нашему мозгу.
Вспомнить об искусственных конечностях заставило это сообщение : британская Shadow Robot Company мастерит робототехническую руку Shadow Hand , а чтобы оптимизировать этот процесс, организация Nesta (National Endowment for Science, Technology and the Arts) решила подкинуть конструкторам деньжат — премию.
75 тысяч фунтов стерлингов должны воодушевить сотрудников компании, чтобы их «руки» протянулись к пожилым и инвалидам. Разговор идёт как о протезах, так и о передвижных манипуляторах, вроде того, который так протяжно ремонтировали на космической станции.
Отец-основатель Shadow Robot Company Ричард Гринхилл.
По поводу манипуляторов поговаривают о подаче полотенца или стакана воды, почёсывании спины и подобном тому. «Робот в первую очередь поможет в мелочах, — вещает директор Shadow Robot Company Ричард Гринхилл (Richard Greenhill). – Конечно, когда мы говорим о роботе, который нужен, чтобы принести стакан воды, это звучит так же глупо, как идея об использовании кувалды для колки орехов, но — это только первый шаг».
Shadow Robot Company (не пора ли выйти из тени?) мы уже однажды упоминали в связи с выставкой ROBODEX 2002. Там британцы держались достойно наравне с японцами, а значит, сэр Гринхилл прибедняется, говоря про первый шаг: «теневики» работают с 1987 года, придумали чудо-технологию Air Muscle («пневматические мускулы»), которая работает, да ещё как.
Британская Shadow Hand способна на 24 движения, а «рука» NASA всего на 12.
В целом же, сообщение о подъёмных 75 тысячах фунтов (немногим более $100 тысяч) выглядит странно: «рука»-то уже готова и, более того, продаётся по 90 тысяч евро. И это ещё не всё: готовы и «ноги» с «туловищем» — это как раз тот Shadow Biped , который радовал на ROBODEX’е. В общем, от британцев имеет смысл ждать чудес небывалых. И главное – совсем скоро.
О манипуляторах на рельсах со стаканом воды больше говорить пока не будем, так как есть вещи поинтересней и, если хотите, пострашней. Имеются в виду, ясное дело, искусственные конечности.
Позвольте вам напомнить некоторые сообщения на эту тему, поступавшие в разное время.

Посетители ROBODEX 2002 наблюдают за «умелой рукой».
Стоит отметить, что ВВС – едва ли не единственное СМИ, которое так внимательно следит за историей с искусственными конечностями, управляемыми чьими-то ни было мозгами.
Вот свежее сообщение как раз про Shadow Hand: «Ричард Гринхилл сообщил BBC News Online, что премиальные пойдут на разработку комплекса навигационных программ и „умственных способностей“: „Робот должен знать всё, например, где находится буфет и как открыть дверь“.
Чтобы на время закрыть тему Shadow Robot Company, добавим, что их „рука“ должна запомнит, где буфет года через три, стоить будет, как автомобиль, а инвалиды не довольны: „Никакой робот-рука не заменит нам простого человеческого общения“.
Вряд ли это недовольство всерьёз – вспомните
В 2014 году посетил я мероприятие под названием GeekPicnic, в основном на все интересные штуки типа "попробовать Oculus Rift" или "порулить квадрокоптером" были гигантские очереди, поэтому я ходил по павильону в поисках чего-нибудь, на что очередей нет.
Немного выделялся из общей массы дядька, стоящий рядом с роботом, очереди к нему не было и выглядел он как-то одиноко и потерянно.
Робот назывался InMoov и выглядел так:
Дядькой оказался его создатель - француз по имени Gael Langevin, а настроение его омрачали два фактора - он не говорил по-русски и робот не привлекал особого внимания, потому что работал от батареи (по типу таких, что стоят в бесперебойниках), которая работала ограниченное время, а потом долго заряжалась, соответственно робот ничего не делал и все проходили мимо. Как я понял, у робота было альтернативное питание от сети, но задействовать его почему-то не могли, поэтому он работал только на батарее.
Я застал как раз момент, когда у создателя что-то спрашивали по-русски / жестами, и не могли понять его ответа на английском, я решил вступить в диалог и сказал что-то на своем ломаном английском, дядька сразу оживился, переспросил "speak english?" и дальше начал с удовольствием рассказывать про своё изобретение.
Пока я слушал про то, что робот разработан так, что его можно напечатать по кусочкам на 3D-принтере и собрать воедино с помощью клея, винтиков, инструкций и такой-то матери, дополнив электронными деталями за ~250 евро, вокруг робота скопились дети и стали теребить единственное, до чего они доставали (нет, не то что вы подумали) - пальцы на руке бедного робота.
Француз посетовал на то, что дети постоянно так делают, и пальцы ломаются. Не насовсем, но каждые 10 минут приходится отверткой что-то подкручивать, чем он и пошел заниматься.
В итоге мы еще минут 20 стояли и я расспрашивал, а он рассказывал про этого робота - кстати, у робота лицо создателя, вышло весьма похоже, особенно вживую.

В общем очень добрый и позитивный дядька этот Gael. Тут батареи зарядились и он стал готовиться к демонстрации способностей робота. Включил его, стал прогонять разные программы, например показывал ему мячик в руке, за которым робот потом следил поворотом головы, давал голосовые команды, чтобы он приветственно махал рукой, вроде бы он мог копировать движение руки, что приводило в восторг детей, которые сразу окружили ожившего робота плотным кольцом.
И вот, Gael в очередной раз командует роботу что-то вроде "Right hand up", "Turn head right", "Rock gesture", "Facepalm" - робот машет руками, кивает головой, закрывает лицо руками, показывает "козу", которая правда не совсем получилась, потому что дети опять замучили указательный палец робота и тот работал через раз.
Gael наконец-то выглядит довольным всеобщим вниманием к своему детищу, окруженному толпой детей и их родителей, и командует ему следующий по списку жест - "Victory gesture", робот послушно дублирует команду перед исполнением "Okay. Victory gesture", и тут я вспоминаю про указательный палец и одновременно вижу, как Gael меняется в лице и такой "No no no no" и этакая непередаваемая гамма эмоций - бессилие остановить робота, смущение за то, что тот еще не начал делать, но сейчас обязательно сделает, переживание за то как это воспримут люди - промелькнула на его лице. Жужжание сервоприводов, медленный поворот руки, та-да!