Тема 9. Метаболический синдром Ф- 165
МЕТАБОЛИЧЕСКИЙ СИНДРОМ.
Понятие «синдром» обычно трактуется как совокупность симптомов, симптомокомплекс. При обсуждении проблемы метаболического синдрома имеется в виду не столько совокупность симптомов, сколько сочетание нескольких заболеваний, объединенных общностью начальных звеньев патогенеза и связанных с определенными расстройствами метаболизма.
Эволюция представлений о метаболическом синдроме формировалась на протяжении почти всего двадцатого столетия, и началом ее следует считать 1922 г., когда в одной из своих работ выдающийся отечественный клиницист Г. Ф. Ланг указал на наличие тесной связи артериальной гипертензии с ожирением, нарушениями липидного и углеводного обмена и подагрой. Хронологию дальнейших событий, приведших к формированию современной концепции метаболического синдрома, можно кратко представить следующим образом:
30-е гг. XX в. М. П. Кончаловский объединил избыточную массу тела, подагру, склонность к заболеваниям сердечно-сосудистой системы и бронхиальной астме термином «артритическая конституция (диатез)»;
1948 г. Е. М. Тареев установил возможность развития артериальной гипертензии на фоне избыточной массы тела и гиперурикемии;
60-е гг. XX в. Дж. П. Камус обозначил сочетание сахарного диабета, гипертриглицеридемии и подагры термином «метаболический трисиндром»;
1988 г. американский ученый Г. М. Ривен предложил термин «метаболический синдром X» для обозначения сочетания нарушений углеводного и липидного обмена, включающего гиперинсулинемию (ГИ), нарушение толерантности к глюкозе (НТГ), гипертриглицеридемию (ГТГ), снижение концентрации холестерина липопротеинов высокой плотности (ХС ЛПВП) и артериальную гипертензию (АГ). Перечисленные симптомы интерпретированы автором как группа нарушений обмена веществ, связанных общностью патогенеза, ключевым звеном развития которого является инсулинорезистентность (ИР). Таким образом, Г. М. Ривен впервые выдвинул теорию метаболического синдрома в качестве нового направления изучения патогенеза мультифакториальных заболеваний.
В дальнейшем, для номинации данного комплекса нарушений метаболизма, были предложены и другие термины: синдром инсулинорезистентности; плюриметаболический синдром: дисметаболический синдром; термин «смертельный квартет» предложен Н. М. Каплан для обозначения сочетания абдоминального ожирения (наиболее существенная, по мнению автора, составляющая синдрома), НТГ, артериальной гипертензии и ГТГ. Большинство авторов придает инсулинорезистентности ведущее значение в патогенезе указанных нарушений, и с этой точки зрения, термин «синдром инсулинорезистентности», предложенный С. М. Хафнер, кажется наиболее приемлемым. Однако другие исследователи считают более важной и главенствующей в развитии данной патологии роль абдоминального ожирения, а не инсулинорезистентности.
Всемирная организация здравоохранения (ВОЗ) (1999 г.) рекомендовала к использованию термин «метаболический синдром». Международная федерация диабета (2005 г.) в состав метаболического синдрома (МС) включила следующие нарушения:
абдоминальное ожирение;
инсулинорезистентность и компенсаторную гиперинсулинемию;
гипергликемию (вследствие снижения толерантности к глюкозе и/или высокая гликемия натощак, вплоть до развития сахарного диабета);
атерогенную дислипидемию (сочетание высоких концентраций триглицеридов, мелких и плотных частиц липопротеидов низкой плотности (ЛПНП) и низкой концентрации холестерина);
артериальную гипертензию;
хроническое субклиническое воспаление (увеличение уровня С-реактивного белка и других провоспалительных цитокинов);
нарушение системы гемостаза: гиперкоагуляция за счет увеличения концентрации фибриногена и снижение фибринолитической активности крови - гипофибринолиз.
Дальнейшие исследования существенно расширили перечень компонентов МС. В последние годы к симптомам, синдромам и заболеваниям, наблюдающимся при метаболическом синдроме, стали относить также:
стеатоз печени;
обструктивное апноэ во сне;
ранний атеросклероз;
гиперурикемию и подагру;
микроальбуминурию;
гиперандрогению и синдром поликистозных яичников.
Согласно современным представлениям, доминирующими сочетаниями в клинической картине МС являются ожирение, артериальная гипертензия, гиперхолестеринемия и сахарный диабет.
Таким образом, представляется возможным определить метаболический синдром как комплекс нарушений нейрогуморальной регуляции углеводного, жирового, белкового и других видов метаболизма, обусловленный инсулинорезистентностью и компенсаторной гиперинсулинемией и являющийся фактором риска развития ожирения, атеросклероза, сахарного диабета второго типа, заболеваний сердечно-сосудистой системы (гипертонической болезни, ишемической болезни сердца) с последующими осложнениями, преимущественно ишемического генеза.
Этиология метаболического синдрома
В генезе метаболического синдрома различают причины (внутренние факторы) и факторы развития процесса нарушений метаболизма (внешние факторы, факторы риска). К причинам МС относятся: генетическая обусловленность или предрасположенность, гормональные расстройства, нарушения процессов регуляции аппетита в гипоталамусе, нарушения продукции жировой тканью адипоцитокинов, возраст более 40 лет. Внешними факторами МС являются гиподинамия, избыточное питание или нарушение адекватного потребностям организма рациона питания, хронический стресс.
Этиологическое действие внутренних причин и внешних факторов в развитии МС характеризуется сложными взаимосвязями и взаимообусловленностью влияния различных их сочетаний. Результатом этого действия и одновременно первичным звеном патогенеза МС является инсулинорезистентность (ИР).
Механизмы формирования инсулинорезистентности. Под резистентностью к инсулину понимается нарушение его биологического действия, проявляющееся в уменьшении инсулинозависимого транспорта глюкозы в клетки и вызывающее хроническую гиперинсулинемию. ИР, как первичная составляющая патогенеза МС, сопровождается нарушением утилизации глюкозы в инсулинчувствительных тканях: скелетных мышцах, печени, жировой ткани, миокарде.
Генетические причины, ведущие к развитию инсулинорезистентности и в последующем МС, обусловлены наследственно закрепленными мутациями генов, контролирующих синтез белков углеводного обмена. Метаболизм углеводов обеспечивается весьма значительным количеством белков, что, в свою очередь, приводит к многообразию возможных генных мутаций и самих генетических причин. В результате мутации генов становятся возможными следующие изменения мембранных белковых структур:
уменьшение количества синтезируемых рецепторов инсулина:
синтез рецептора измененной структуры;
нарушения в системе транспорта глюкозы в клетку (GLUT-белки);
нарушения в системе передачи сигнала от рецептора в клетку:
изменения активности ключевых ферментов внутриклеточного метаболизма глюкозы - гликогенсинтетазы и пируватдегидрогеназы.
Конечным итогом этих модификаций является формирование ИР.
В качестве имеющих основное значение в развитии Иг выделяют мутации генов белков, передающих сигнал инсулина, белка-субстрата инсулинового рецептора, гликогенсинтетазы, гормоночувствительной липазы, р 3 -адренорецепторов, фактора некроза опухолей а (ФНО-а) и др.
В развитии нарушений процессов регуляции аппетита в гипоталамусе наиболее изучена роль лептина - белкового гормона, секретируемого адипоцитами. Основное действие лептина - подавление аппетита и увеличение энергетических затрат. Оно осуществляется через снижение продукции нейропептида-Y в гипоталамусе. Выявлено прямое действие лептина на вкусовые клетки, приводящее к торможению пищевой активности. Снижение активности лептина по отношению к регуляторному центру гипоталамуса тесно связано с висцеральным ожирением, которое сопровождается относительной резистентностью гипоталамуса к центральному действию гормона и, как следствие, избыточностью питания и нарушениями его привычного рациона.
Старение (возраст более 40 лет) и висцеральное ожирение играют важную роль в развитии ведущих к инсулинорезистентности гормональных нарушений, проявляющихся:
ростом концентраций тестостерона, андростендиона и снижением прогестерона у женщин;
снижением тестостерона у мужчин;
снижением концентрации соматотропина;
гиперкортицизмом;
гиперкатехоламинемией.
Жировая ткань обладает способностью к секреции большого числа биологически активных веществ, многие из которых могут вызвать развитие ИР. К ним относятся так называемые «адипоцитокины»: лептин, адипсин, протеинстимулятор ацилирования, адипонектин, ФНО-а, С-реактивный белок, интерлейкин-1 (ИЛ-1), интерлейкин-6 (ИЛ-6) и другие. Рост массы тела за счет висцеральной жировой ткани приводит к нарушениям продукции жировой тканью адипоцитокинов. Механизм действия лептина был уже описан выше. Что касается других адипоцитокинов, то их влияние весьма разнообразно и зачастую синергично.
Например, адипсин при отсутствии поступления пищи стимулирует центр голода в гипоталамусе, вызывая повышенный аппетит, избыточное потребление пищи и рост массы тела.
Белок-стимулятор ацилирования посредством активации захвата глюкозы жировыми клетками стимулирует процесс липолиза, что, в свою очередь, приводит к стимуляции диацилглицеролацилтрансферазы, ингибированию липазы и росту синтеза триглицеридов.
Обнаружено, что недостаточность адипонектина, наблюдающаяся при ожирении, является причиной ИР, снижает антиатерогенные свойства цитокина и ассоциирована со снижением чувствительности к инсулину у женщин с гиперандрогенемией.
С нарастанием массы тела резко растет продукция ФНО-а, что снижает активность тирозинкиназы инсулинового рецептора, фосфорилирование его субстрата и приводит к торможению экспрессии GLUT-белков внутриклеточного транспорта глюкозы. Установлен синергизм подобного действия ФНО-а с ИЛ-1 и ИЛ-6. Совместно с ИЛ-6 и С-реактивным белком ФНО-а вызывает активацию коагуляции.
Влияние старения (возраст более 40 лет) как внутренней причины ИР тесно взаимосвязано и опосредуется через действие других причин и факторов МС: генетических дефектов, гиподинамии, избыточной массы тела, гормональных нарушений, хронического стресса.
Механизмы, ведущие к формированию ИР, при старении сводятся в основном к следующим последовательным изменениям. Старение, наряду со снижением физической активности, ведет к уменьшению выработки соматотропного гормона (СТГ). Рост уровня кортизола, вызванный повышением социальной и личностной напряженности, неизменно сопровождающим процесс старения, также является фактором снижения продукции СТГ. Дисбаланс этих двух гормонов (снижение СТГ и рост кортизола) является причиной развития висцерального ожирения, которое, кроме того, стимулируется избыточным питанием. Висцеральное ожирение и связанное с хроническим стрессом повышение симпатической активности приводят к росту уровня свободных жирных кислот, снижающих клеточную чувствительность к инсулину.
Гиподинамия - как фактор риска, неблагоприятно влияющий на чувствительность тканей к инсулину сопровождается снижением транслокации белков транспорта глюкозы (GLUT-белков) в миоцитах. Последнее обстоятельство представляет один из механизмов формирования ИР. У более 25 % субъектов, ведущих малоподвижный образ жизни, обнаруживается инсулинорезистентность.
Избыточное питание и сопутствующее ему нарушение адекватного потребностям организма рациона питания (в частности, чрезмерное потребление животных жиров) ведут к структурным изменениям фосфолипидов клеточных мембран и угнетению экспрессии генов, контролирующих передачу в клетку инсулинового сигнала. Данные расстройства сопровождаются гипертриглицеридемией, приводящей к избыточному отложению липидов в мышечной ткани, что нарушает активность ферментов углеводного метаболизма. Особенно выражен этот механизм формирования ИР у пациентов с висцеральным ожирением.
Наследственная предрасположенность к ИР и ожирению, сочетающаяся с гиподинамией и избыточным питанием, порождает порочный круг патогенеза МС. Компенсаторная ГИ, вызванная ИР, приводит к снижению, а в дальнейшем блокирует чувствительность рецепторов инсулина. Следствием этого является депонирование жировой тканью липидов и глюкозы, поступающих с пищей, что усиливает ИР, а вслед за этим и ГИ. Гиперинсулинемия оказывает угнетающее влияние на липолиз, что вызывает прогрессирование ожирения.
Действие хронического стресса , как внешнего фактора развития метаболического синдрома, связано с активацией симпатического отдела автономной нервной системы и ростом концентрации кортизола в крови. Симпатикотония является одной из причин развития инсулинорезистентности. В основе этого действия находится способность катехоламинов усиливать липолиз с повышением концентрации свободных жирных кислот, что приводит к формированию ИР. Инсулинорезистентность, в свою очередь, оказывает непосредственное активирующее влияние на симпатический отдел автономной нервной системы (АНС). Таким образом, происходит формирование порочного круга: симпатикотония - рост концентрации свободных жирных кислот (СЖК) - инсулинорезистентность - повышение активности симпатического отдела АНС. Кроме того, гиперкатехоламинемия, ингибируя экспрессию GLUT-белков, приводит к торможению инсулинобусловленного транспорта глюкозы.
Глюкокортикоиды уменьшают чувствительность тканей к инсулину. Реализуется это действие через увеличение количества жировой ткани в организме за счет усиления аккумуляции липидов и торможения их мобилизации. Были обнаружены полиморфизм гена глюкокортикоидного рецептора, который связан с увеличением секреции кортизола, а также полиморфизм генов допаминовых и лептиновых рецепторов, связанный с повышенной активностью симпатического отдела нервной системы при МС. Обратная связь в гипоталамо-гипофизарно-надпочечниковой системе становится неэффективной при полиморфизме в пятом локусе гена глюкокортикоидного рецептора. Это нарушение сопровождается инсулинорезистентностью и абдоминальным ожирением.
Рост уровня кортизола оказывает как непосредственное, так и опосредованное (через снижение уровня соматотропина) действие на формирование висцерального ожирения, которое приводит к росту СЖК и развитию инсулинорезистентности.
Патогенез метаболического синдрома.
Инсулинорезистентность, причины развития которой описаны выше, является центральным звеном патогенеза и объединяющей основой всех проявлений метаболического синдрома.
Следующим связующим звеном патогенеза МС является системная гиперинсулинемия. С одной стороны, ГИ представляет собой физиологическое компенсаторное явление, направленное на поддержание нормального транспорта глюкозы в клетки и преодоление ИР, а с другой - выполняет важнейшую роль в развитии метаболических, гемодинамических и органных нарушений, характерных для МС.
Возможность возникновения, а также формы клинических проявлений ГИ тесно связаны с наличием генетической обусловленности или предрасположенности. Так, у лиц, являющихся носителями гена, ограничивающего способность (3-клеток поджелудочной железы к усилению секреции инсулина, ИР приводит к развитию сахарного диабета (СД) 2-го типа. У субъектов, носителей гена, управляющего Nа + /К + -клеточным насосом, ГИ сопровождается развитием внутриклеточного накопления Na и Са и увеличением чувствительности клеток к действию ангиотензина и норадреналина. Конечным результатом действия приведенных расстройств метаболизма является развитие артериальной гипертензии. Сочетание ГИ с преобладанием первичных наследственно обусловленных изменений липидного состава крови может стимулировать экспрессию соответствующего гена и инициировать возникновение фенотипа, характеризующегося повышением уровня липопротеинов низкой плотности (ЛПНП) и снижением уровня липопротеинов высокой плотности (ЛПВП), что приводит к развитию атеросклероза и связанных с ним заболеваний систем организма и, в первую очередь, системы кровообращения.
Важную роль в развитии и прогрессировании инсулинорезистентности и связанных с ней метаболических расстройств играют жировая ткань абдоминальной области, нейрогуморальные нарушения, сопутствующие абдоминальному ожирению, повышенная активность симпатической нервной системы.
Опубликованные в 1983 г. результаты Фремингемского исследования свидетельствуют, что ожирение является самостоятельным фактором риска сердечно-сосудистых заболеваний. При проспективном 26-летнем наблюдении за 5209 мужчинами и женщинами с использованием метода регрессионного анализа установлено, что увеличение исходной массы тела явилось фактором риска развития ишемической болезни сердца (ИВС), смертей от ИБС и сердечной недостаточности, не зависящим от возраста, уровня холестерина в крови, курения, величины систолического артериального давления (АД), гипертрофии левого желудочка и нарушений толерантности к глюкозе.
Риск развития сердечно-сосудистых заболеваний и инсулиннезависимого СД при ожирении обусловлены не столько наличием ожирения, сколько его типом.
На связь между характером распределения жира и возможностью развития атеросклероза, артериальной гипертензии, инсулиннезависимого сахарного диабета и подагры впервые обратил внимание Вагю в 1956 г. Им было предложено принятое в настоящее время выделение андроидного (центрального, ожирения верхней половины тела, висцероабдоминального) и ганоидного (преимущественно нижней половины тела, глютеофеморального) ожирения.
Центральный тип ожирения развивается обычно после 30 лет и связан с нарушениями обратной физиологической связи в гипоталамо-гипофизарно-надпочечниковой системе: снижением чувствительности гипоталамо-гипофизарной зоны к тормозящему влиянию кортизола, вследствие возрастных изменений и хронического психоэмоционального стресса. В результате развивается гиперкортицизм. Клиническая картина абдоминального ожирения сходна с распределением жировой ткани при истинном синдроме Кушинга. Небольшой, но хронический избыток кортизола активирует кортизолзависимую липопротеиновую липазу на капиллярах жировых клеток верхней половины туловища, брюшной стенки и висцеральной жировой ткани, что ведет к увеличению депонирования жира и гипертрофии адипоцитов перечисленных областей. Одновременно повышенная концентрация кортизола снижает чувствительность тканей к инсулину, способствует развитию инсулинорезистентности и компенсаторной ГИ, которая стимулирует липогенез (образование жира в ответ на его потери в процессе липолиза) и тормозит липолиз (распад жира с освобождением жирных кислот и глицерола). Глюкокортикоиды оказывают влияние на центры, регулирующие аппетит, и активность автономной нервной системы. Под действием глюкокортикоидов происходит экспрессия генов, ответственных за адипогенез.
Висцеральная жировая ткань, в отличие от жировой ткани другой локализации, богаче иннервирована, обладает более широкой сетью капилляров, непосредственно связанных с портальной системой. Висцеральные адипоциты имеют высокую плотность р 3 -адренорецепторов, рецепторов к кортизолу и андрогенным стероидам и относительно низкую плотность инсулиновых и р 2 _ адренорецепторов. Это обуславливает высокую чувствительность висцеральной жировой ткани к липолитическому эффекту катехоламинов, большую, чем стимулирующее липогенез влияние инсулина.
На основе приведенных анатомических и функциональных особенностей висцеральной жировой ткани была сформулирована портальная теория инсулинорезистентности, предполагающая, что ИР и связанные с ней проявления обусловлены избыточным поступлением свободных жирных кислот в печень через портальную вену, осуществляющую отток крови от висцеральной жировой ткани. Это снижает активность процессов связывания и деградации инсулина в гепатоцитах и ведет к развитию инсулинорезистентности на уровне печени и торможению супрессивного действия инсулина на продукцию глюкозы печенью. Попадая в системный кровоток, СЖК способствуют нарушению поглощения и утилизации глюкозы в мышечной ткани, вызывая периферическую инсулинорезистентность.
Доказано непосредственное влияние СЖК, образующихся в процессе липолиза, на функционирование ферментов и белков транспорта, принимающих участие в метаболизме глюкозы и синтезе гликогена. В присутствии возросших концентраций СЖК в печени и мышцах снижаются активность и чувствительность к инсулину ферментов гликолиза, гликогенеза, наблюдается усиление глюконеогенеза в печени. Клиническим проявлением перечисленных процессов является повышение концентрации глюкозы (натощак), нарушение ее транспорта и возрастание инсулинорезистентности.
Одним из важных аспектов патогенеза МС является его атерогенный потенциал, то есть риск развития сердечно-сосудистых осложнений, обусловленных атеросклерозом.
Наиболее типичными нарушениями липидного обмена при МС являются повышение концентрации триглицеридов и понижение концентрации холестерина липопротеинов высокой плотности (ХС ЛПВП) в плазме крови. Реже встречается повышение общего холестерина (ХС) и ХС ЛПНП. Удаление ЛПНП из крови регулируется липопротеинлипазой (ЛПЛ). Этот фермент находится под контролем концентрации инсулина в крови. При развитии ожирения, СД 2 типа и при синдроме инсулинорезистентности ЛПЛ становится резистентной к действию инсулина. Избыточное количество инсулина стимулирует прохождение ЛПНП в стенку артерий и активирует захват моноцитами холестерина. Инсулин также стимулирует миграцию гладкомышечных клеток в интиму и их пролиферацию. В интиме гладкомышечные клетки с моноцитами, наполненными ХС, образуют пенистые клетки, что приводит к формированию атероматозной бляшки. Способствуя образованию атеросклеротической
бляшки, инсулин препятствует возможности ее обратного развития. Инсулин также активирует адгезию и агрегацию тромбоцитов, выработку ими тромбоцитарных факторов роста.
Артериальная гипертензия часто является одним из первых клинических проявлений метаболического синдрома. Основными гемодинамическими нарушениями при МС являются повышение объема циркулирующей крови, сердечного выброса, общего периферического сосудистого сопротивления.
Механизмы, благодаря которым инсулинорезистентность приводит к развитию АГ, полностью не раскрыты. Предполагается, что инсулин действует на мембранные каналы клеток, регулирующие поступление натрия и кальция внутрь клетки. Внутриклеточный кальций является одним из факторов, определяющих напряжение и сократимость миоцитов сосудов в ответ на действие сосудосуживающих факторов. Доказано, что поступление кальция в гладкомышечные клетки и тромбоциты под действием инсулина снижается. При ИР инсулин не способен уменьшать приток кальция в клетки, что, вероятно, играет роль в развитии АГ.
Гиперинсулинемия, являясь одним из ведущих факторов повышения артериального давления при МС, приводит к следующим эффектам:
повышению активности симпатической нервной системы;
активации реабсорбции натрия и воды в канальцах почек, что ведет к увеличению объема циркулирующей крови;
стимуляции трансмембранного обмена ионов натрия и водорода, ведущей к накоплению натрия в гладкомышечных клетках сосудов, повышая их чувствительность к эндогенным прессорным агентам (норадреналин, ангиотензин-2 и др.) и увеличивая периферическое сосудистое сопротивление;
модуляции а 2 -адренергической передачи импульсов на уровне сосудистой стенки;
ремоделированию стенки сосудов за счет стимуляции пролиферации гладкомышечных клеток.
Повышение активности симпатической нервной системы на фоне гиперинсулинемии реализуется, главным образом, через центральные звенья симпатической регуляции кровообращения - угнетение активности а 2 -адренорецепторов и Ij-имидазолиновых рецепторов. Есть данные о прогипертензивной роли лептина, реализуемой через стимуляцию симпатической активности.
Увеличение периферического сосудистого сопротивления приводит к уменьшению почечного кровотока, вызывая активацию ренин-ангиотензин-альдостероновой системы.
Важный вклад в генез АГ при метаболическом синдроме вносит дисфункция эндотелия сосудов. Эндотелий является «органом-мишенью» инсулинорезистентности. При этом усиливается продукция эндотелием вазоконстрикторов, снижается секреция вазодилятаторов (простациклина, окиси азота).
Нарушение гемореологических свойств крови (увеличение содержания фибриногена и повышение активности ингибитора тканевого плазминогена) в сочетании с гиперлипидемией способствует тромбообразованию и нарушению микроциркуляции в жизненно важных органах. Это способствует раннему поражению таких «органов-мишеней» АГ как сердце, головной мозг, почки.
Алгоритмы диагностики.
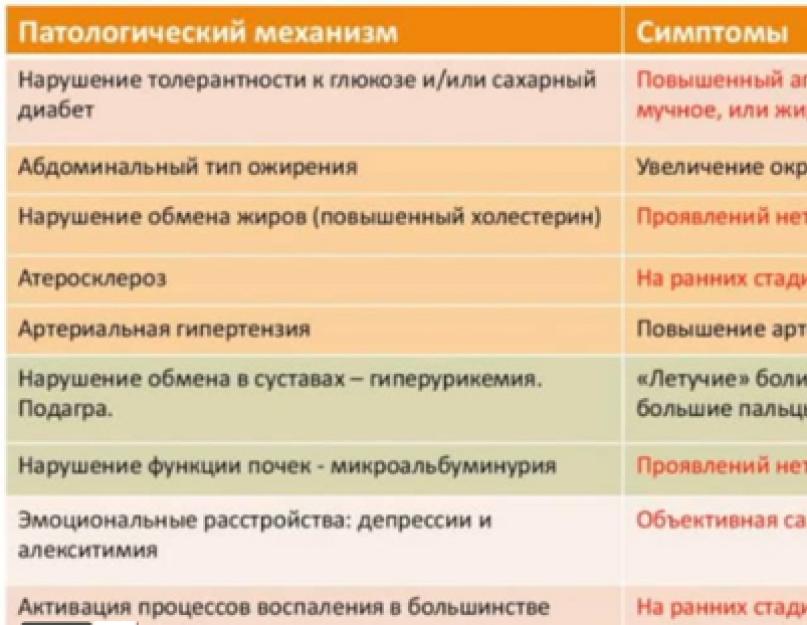
Основными симптомами и проявлениями метаболического синдрома являются:
инсулинорезистентность и гиперинсулинемия;
нарушение толерантности к глюкозе и СД 2-го типа;
артериальная гипертензия;
абдоминально-висцеральное ожирение;
дислипидемия;
ранний атеросклероз и ИБС;
гиперурикемия и подагра;
нарушения гемостаза;
микроальбуминурия;
гиперандрогения у женщин и снижение тестостерона у мужчин.
Приведенный перечень только основных проявлений, входящих в состав МС,
весьма обширен. Однако для диагностики метаболического синдрома нет необходимости в определении всех его составляющих. Данному виду патологии свойственны ассоциации клинических проявлений, отличающиеся составом компонентов. Взаимодействие различных генетических причин и факторов риска приводит к определенному частичному фенотипу метаболического синдрома, характеризующемуся своеобразным сочетанием симптомов, синдромов и заболеваний.
Основной задачей диагностики МС является выявление начальных маркеров синдрома и назначение дополнительных исследований для обнаружения латентно протекающих расстройств метаболизма. Наиболее ранними проявлениями МС являются дислипидемия, АГ, различные лабораторные маркеры ИР, висцеральное ожирение.
Метаболический синдром (МС) - это нарушение обмена веществ, при котором клетки теряют чувствительность к инсулину (гормон, вырабатываемый клетками поджелудочной железы), необходимый для того, чтобы в клетку попала глюкоза, и клетка начала работать - вырабатывать энергию. В результате весь инсулин остается в крови. Чем больше инсулина, тем больше накапливается жира, преимущественно в области живота, вокруг внутренних органов (ожирение печени и др.). Современной наукой доказано, что жировая клетка вырабатывает гормоны, которые способствуют дальнейшему нарушению обмена веществ, поражению сердечно-сосудистой системы, нарушению работы половой системы.
Метаболический синдром - это "пред-диабет 2-го типа".
Метаболический синдром у женщин и у мужчин - симптомы
Первым звонком развития метаболического синдрома является наличие у женщины окружности талии более 80 см, а у мужчины - более 94 см. Если вышеуказанные размеры сочетаются с повышением АД выше, чем 130/85 мм рт. ст., уровнем глюкозы более 5,6 ммоль/л, или повышением в крови уровня холестерина, то наличие метаболического синдрома не вызывает сомнений.
Слайд 1. Критерии метаболического синдрома по версии международной федерации диабета:
Слайд 2. Как мы можем заметить метаболический синдром

Метаболический синдром - причины
Основные причины метаболического синдрома:
- возрастные изменения гормональной регуляции;
- избыточное потребление высококалорийной пищи;
- гиподинамия.
Главный "спусковой крючок" всех процессов метаболического синдрома - это ИНСУЛИНОРЕЗИСТЕНТНОСТЬ, - невосприимчивость организма к инсулину.
Инсулин обеспечивает поступление глюкозы в клетку. Если клетка начинает "голодать" от недостатка глюкозы, то в мозг поступает сигнал о том, что нужно: 1) срочно съесть что-то сладкое (увеличить уровень глюкозы), 2) срочно увеличить выработку инсулина, который доставит эту глюкозу в клетку.
В случае метаболического синдрома НАРУШАЕТСЯ МЕХАНИЗМ доставки глюкозы в клетку, то есть получается так, что в крови глюкозы МНОГО ("повышенный уровень сахара"), а в клетку эта глюкоза не попадает (и человек страдает от слабости и недостатка энергии).
В чем причина этой "инсулинорезистентности"? Дело в том, что внутри клетки находятся регуляторы, которые контролируют уровень поступающей глюкозы. Если глюкозы поступит больше, чем надо, то клетка погибнет. Поэтому, чтобы клетка открыла "ворота" для поступления глюкозы, внутри этой клетки сначала должна произойти целая цепочка событий с участием микроРНК.
Клетке нужно очень много нуклеотидов, которые будут строить микроРНК, которые в свою очередь будут управлять процессом усвоения глюкозы. Но с возрастом этого строительного материала в виде нуклеотидов становится все меньше и меньше.
Метаболический синдром - лечение
В первую очередь, лечение метаболического синдрома должно быть направлено на решение проблемы избыточного веса. Необходимо увеличить двигательную активность, уменьшить калорийность питания.
Очень важный момент: необходимо добавить в рацион питания необходимые организму витамины и микроэлементы, особенно те, которые помогают организму в построении микроРНК, которые будут управлять усвоением глюкозы. Организму нужны нуклеотиды.
Восполнить дефицит нуклеотидов в организме можно препаратами Диэнай. Практически все препараты линейки Диэнай являются источником нуклеотидов.
Если речь идет о метаболическом синдроме у женщин , то можно порекомендовать такие препараты, как Панмелан , Диэнай .
При метаболическом синдроме у мужчин рекомендуется препарат Таркус . Таркус - это препарат, который помогает мужскому организму поддерживать гормональный фон, поддерживать уровень тестостерона (главного мужского гормона). Снижение уровня тестостерона сопровождается снижением мышечной массы и силы, увеличением жировой ткани, остеопорозом, снижением тонуса и толщины кожи ("дряблость" кожи). Между тем, увеличение массы тела за счет жировой ткани приводит к дальнейшему снижению тестостерона. Возникает "порочный круг", когда избыток жира в организме со временем может превратить мужчину в существо среднего пола. Дело в том, что в мужском организме кроме андрогенов и тестостерона всегда вырабатывается небольшое количество женских гормонов, а в женском - мужских. Если вес мужчины выше нормы на 30%, эндокринная система приостанавливает производство тестостерона и наращивает выработку эстрогенов и прогестерона. Под их воздействием мужская фигура принимает женоподобные формы. Наш препарат Таркус помогает мужскому организму вырабатывать свой собственный тестостерон, тем самым помогает преодолеть это состояние.
Метаболический синдром (МС) называют пандемией XXI века. Его распространенность составляет 20 – 40%, а у пожилых женщин частота этого состояния достигает 50% и более. МС в несколько раз увеличивает вероятность появления сахарного диабета 2 типа (СД2), (АГ) и смерти от . Кроме того, при МС поражаются почки и печень. Этот синдром считают доклинической стадией развития и СД2. При своевременном лечении явления его обратимы, риск осложнений значительно снижается. Этим обусловлена важность изучения этой темы.
Почему возникает метаболический синдром
Точная причина заболевания науке неизвестна, однако выделены факторы, провоцирующие его развитие:

Рассмотрим более подробно гормональные нарушения у женщин, потому что такие нарушения определяют у них развитие МС.
В возрасте 50 – 60 лет у 60% женщин увеличивается масса тела на 2 – 5 кг и более. Ожирение приобретает черты не гиноидного (женского), а андроидного (мужского) типа. Это вызвано снижением выработки в яичниках женских половых гормонов (эстрогенов). При этом синтез мужских половых гормонов в надпочечниках и яичниках не меняется. Тестостерон (мужской половой гормон) у женщин вызывает накопление жировой ткани вокруг внутренних органов, то есть висцеральное ожирение.
Итак, повышение массы тела связано с возрастными особенностями обмена веществ и дисбалансом половых гормонов с преобладанием андрогенов. Ожирение имеет черты абдоминального, то есть жир накапливается не в области бедер, а в зоне живота.
Дисбаланс половых гормонов непосредственно влияет на обмен липидов, увеличивая содержание в крови «плохого» холестерина (липопротеидов низкой плотности) и уменьшая концентрацию «хорошего» (липопротеидов высокой плотности).
Устранение менструальной функции у женщин независимо от возраста (в результате заболеваний, операций, менопаузы) приводит к нарушению функции внутренней оболочки сосудов (эндотелиальной дисфункции) и повышению артериального давления. Дефицит эстрогенов – один из независимых факторов повышения артериального давления у женщин.
При дисфункции яичников снижается секреция прогестерона, активируется ренин-ангиотензин-альдостероновая система, что вызывает повышение артериального давления и формирование висцерального типа ожирения.
Все перечисленное свидетельствует о важной роли гормонального фона женщины в формировании у нее признаков МС. Ученые сформулировали концепцию «менопаузального метаболического синдрома», акцентирующую внимание на высоком риске этого заболевания у женщин старше 45 лет.
Клинические признаки

Компоненты МС:
- нарастание жировых отложений вокруг внутренних органов;
- уменьшение реакции тканей на инсулин, ухудшение усвоения ими глюкозы;
- повышение уровня инсулина в крови.
В результате нарушается обмен углеводов, жиров, мочевой кислоты и повышается артериальное давление.
Главный признак МС у женщин – увеличение окружности талии более 80 см.
Дополнительные признаки:
- артериальная гипертония;
- увеличение содержания в крови триглицеридов;
- снижение уровня «хорошего» холестерина;
- повышение количества «плохого» холестерина;
- нарастание уровня сахара в крови;
- нарушение толерантности к глюкозе.
МС диагностируется при наличии главного и любых двух дополнительных признаков.
МС развивается постепенно. У пациенток с выраженным заболеванием его можно заподозрить еще при осмотре. Жир у них распределен по андроидному типу. Самые интенсивные отложения отмечаются в области живота и плечевого пояса. При выявлении такого типа ожирения назначаются дополнительные диагностические исследования.
Диагностика
 Увеличение окружности живота - один из объективных признаков метаболического синдрома.
Увеличение окружности живота - один из объективных признаков метаболического синдрома. На уровне поликлиники выполняются такие исследования и измерения:
- рост и вес;
- окружность талии;
- определение индекса массы тела;
- анализ на сахар крови натощак;
- тест на толерантность к глюкозе;
- анализ на содержание общего холестерина, триглицеридов, мочевой кислоты, тестостерона;
В условиях стационара могут быть выполнены следующие исследования:
- тест на толерантность к глюкозе с определением уровня инсулина (для оценки ИР);
- исследование липидного спектра;
- определение микроальбуминурии;
- изучение показателей свертывания крови;
- компьютерная или магнитно-резонансная томографии гипофиза и надпочечников;
- ультразвуковое исследование щитовидной железы;
- определение гормонального фона пациентки.
Лечение
 Правильное питание с увеличением в рационе овоще и фруктов поможет сбросить лишние килограммы.
Правильное питание с увеличением в рационе овоще и фруктов поможет сбросить лишние килограммы. Принципы лечения МС у женщин:
- снижение массы тела;
- коррекция гормональных нарушений;
- нормализация артериального давления;
- профилактика сердечно-сосудистых осложнений.
Основа лечения – немедикаментозные методы, направленные на снижение массы тела. Достаточно снизить вес на 5 – 10% от исходного, не применяя жестких диет. Для снижения веса необходимо сформировать пищевое поведение, которое поможет закрепить результат. Женщина должна умеренно снизить калорийность пищи, отказаться от животных жиров, вести дневник питания. Следует как можно больше использовать в питании низкокалорийные и обезжиренные продукты. Кратковременные низкокалорийные диеты и голодание не приводят к длительному снижению массы тела. Оптимальной считается потеря 2 – 4 кг в месяц.
Обязательным является увеличение физической активности. Имеет значение не интенсивность, а продолжительность нагрузки и пройденное расстояние. Таким образом, предпочтительнее часовая прогулка в умеренном темпе, чем 30-минутный бег трусцой.
Дополнительно могут назначаться лекарственные препараты для лечения ожирения, в частности, орлистат.
Сибутрамин и его аналоги не должны применяться, поскольку резко увеличивают риск сердечно-сосудистых осложнений (инсульт, ).
При ожирении II – IV степени используются хирургические методы:
- бандажирование желудка (эндоскопическая операция, при которой на желудок надевается специальное кольцо, делящее его на две камеры);
- рукавная резекция желудка (удаление части органа с сохранением всех его физиологических функций);
- гастрошунтирование (уменьшение объема желудка и изменение продвижения пищи по желудочно-кишечному тракту);
- билиопанкреатическое шунтирование;
- мини-гастрошунтирование.
Помимо лечения ожирения, в терапии МС используются следующие направления:

Первый городской телеканал г. Одесса, медицинская справка на тему «Метаболический синдром»:
Эндокринолог, диетолог Наталья Гальцева рассказывает о метаболическом синдроме: