И.М. ЩЕРБЕНКОВ , к.м.н., ЦЭЛТ, Москва
Бактерии, резистентные к большинству или ко всем из всех известных антибиотиков, вызывают все более серьезные проблемы. Это увеличивает риск возврата медицинского сообщества к проблемам того периода, когда антибиотики были неизвестны и широко распространены неизлечимые инфекции и эпидемии. Несмотря на интенсивную работу ведущих химиков и фармацевтов всего мира, за последние 30 лет резко снизился синтез новых классов антибиотиков, и в ближайшее время не предвидится поступления в клиническую практику принципиально новых представителей антибактериальных средств. Есть надежда, что вновь обнаруженная возможность полностью секвенировать микробные геномы и определять молекулярные основы патогенности откроет новые пути лечения инфекционных заболеваний, но все с большим рвением идет поиск других подходов к этой проблеме.
Одним из результатов такого поиска является вновь возникший интерес к возможностям терапевтического использования бактериофагов (от бактерии и греч. phagos пожиратель; букв. пожиратели бактерий) специфических вирусов, которые атакуют только бактерии и убивают патогенные микроорганизмы. Бактериофаги обладают способностью проникать в бактериальные клетки, репродуцироваться в них и вызывать их лизис.
История изучения и применения бактериофагов
В 1896 г. Эрнест Ханкин сообщил, что воды рек Ганга и Джамна в Индии обладают значительной антибактериальной активностью, которая сохранялась после прохождения через фарфоровый фильтр с порами очень малого размера, но устранялась при кипячении. Наиболее подробно изучал он действие неизвестной субстанции на Vibrio cholerae и предположил, что она ответственна за предупреждение распространения эпидемий холеры, вызванных употреблением воды из этих рек. Однако в последующем он не объяснил этот феномен.
В 1898 г. впервые перевиваемый лизис бактерий (сибиреязвенной палочки) наблюдал русский микробиолог Н.Ф. Гамалея.
Официально бактериофаги были открыты почти через 20 лет независимо друг от друга Ф. Туортом совместно с А. Лондом и Ф. д"Эрелем как фильтрующиеся, передающиеся агенты разрушения бактериальных клеток. Английский ученый Ф. Туорт в 1915 г. описал явление лизиса у гнойного стафилококка и открыл первый «вирус, пожирающий бактерии», когда наблюдал любопытное дегенеративное изменение лизис в культурах стафилококков из лимфы теленка. С его именем связано название «феномен Туорта». В 1917 г. Феликс д’Эрель делает аналогичное открытие, именно он дал им название «бактериофаги», используя суффикс «фаг» не в его прямом смысле «есть», а в смысле развития за счет чего-то.
В 1980-е гг. эффективность лечения антибиотиками значительно понизилась, бактерии активно вырабатывают лекарственную устойчивость. Чтобы создать новый сильнодействующий антибиотик, фармацевтические компании сегодня должны в среднем потратить 10 лет и 800 млн долл. Это послужило поводом к повышенному интересу к фаговой терапии. В начале 2000-х гг. Гленн Моррис, сотрудник Университета Мэриленд (США), совместно с НИИ бактериофагов, микробиологии и вирусологии в Тбилиси наладил испытания фаговых препаратов для получения лицензии на их применение в США. И уже в июле 2007 г. бактериофаги одобрены для использования в США. На протяжении последних нескольких лет исследования свойств бактериофагов проводятся в России, Грузии, Польше, Франции, Германии, Финляндии, Канаде, США, Великобритании, Мексике, Израиле, Индии, Австралии.
Характеристика фагов
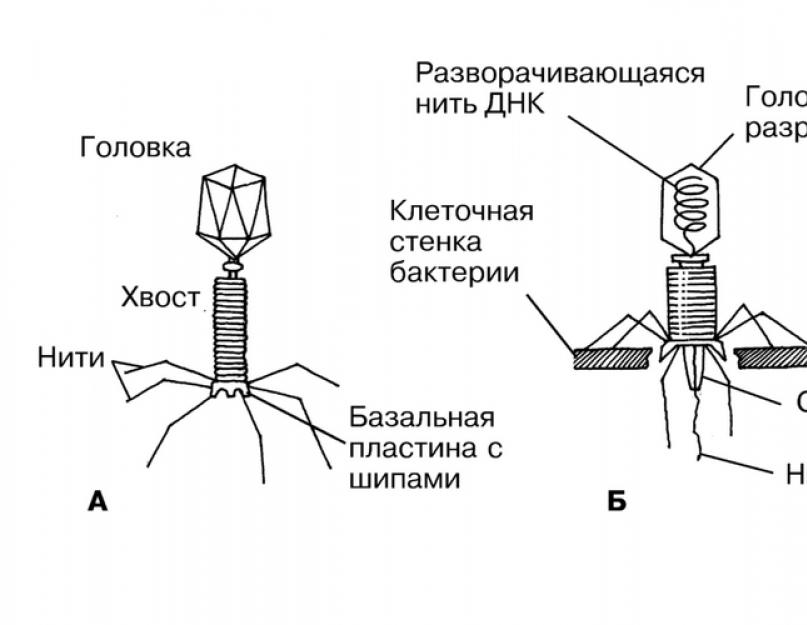
Применение современных электронных микроскопов, а также усовершенствование методов приготовления препаратов для электронной микроскопии позволили более детально изучить тонкую структуру фагов. Оказалось, что она весьма разнообразна и у многих фагов более сложна, чем структура вирусов растений и ряда вирусов человека и животных. Бактериофаги, как и другие вирусы, несут свою генетическую информацию в форме ДНК либо РНК. Большинство бактериофагов имеют хвостики, кончики которых прикреплены к конкретным рецепторам, таким как молекулы углеводов, белков и липополисахаридов на поверхности бактерии-хозяина. Бактериофаг впрыскивает свою нуклеиновую кислоту в хозяина, где он использует генетический механизм хозяина, чтобы реплицировать свой генетический материал, и считывает его, чтобы сформировать новый фагокапсульный материал для создания частичек нового фага. Число фагов, произведенных в течение единичного цикла инфекции (размер выхода), варьирует между 50 и 200 новыми фаговыми частицами.
Лизогенизация бактерий сопровождается изменением их морфологических, культуральных, ферментативных, антигенных и биологических свойств. Так, например, нетоксигенные штаммы коринебактерий дифтерии в результате лизогенизации превращаются в токсигенные.
Практическое использование фагов
Фаготерапия (применение бактериальных вирусов для лечения бактериальных инфекций) была проблемой, весьма интересующей ученых еще 60 лет назад. Открытие пенициллина и других антибиотиков в 1940-х гг. обеспечило более результативный и многосторонний подход к подавлению вирусных заболеваний и спровоцировало к закрытию работ в данной области.
В связи с катастрофически возрастающей антибиотикорезистентностью и отсутствием в ближайшей перспективе новых антибактериальных средств возродился активный интерес к фаготерапии.
Научные данные последних десятилетий доказывают, что в отличие от антибиотиков препараты бактериофагов имеют следующие положительные качества:
Размножаясь, они самостоятельно регулируют свою численность (увеличивая или уменьшая ее), поскольку размножаются только до тех пор, пока имеются чувствительные бактерии, а затем постепенно элиминируются из организма и окружающей среды;
они гораздо более специфичны, чем большинство антибиотиков; будучи нацелены на конкретные проблемные бактерии, вызывают гораздо меньшее повреждение нормального микробного баланса организма. Бактериальный дисбаланс, или «дисбиоз», вызванный лечением многими антибиотиками, может привести к серьезным вторичным инфекциям с участием достаточно резистентных бактерий, увеличивающим затраты на лечение и летальность. Специфические проблемы, возникающие в результате, включают инфекции, вызванные псевдомонадами, трудно поддающиеся лечению, и Clostridium difficile, причину серьезной диареи и псевдомембранозного колита;
фаги имеют возможность использовать в качестве мишеней рецепторы на бактериальной поверхности, участвующие в патогенезе, а это означает, что вирулентность любых резистентных к ним мутантов ослаблена;
в отношении фаговой терапии описано мало побочных эффектов;
фаговая терапия была бы особенно применима для лиц с аллергией к антибиотикам;
должным образом селекционированные фаги можно легко использовать профилактически, способствуя предотвращению бактериальных заболеваний у людей или животных при контакте с микробами, либо для санации больниц и борьбы с госпитальными инфекциями;
фаг можно использовать либо независимо, либо в сочетании с другими антибиотиками, с целью уменьшения вероятности развития резистентности бактерий;
фаги не воздействуют на нормофлору кишечника и препараты эубиотиков и протобиотиков, что дает возможность для их совместного применения.
Обладая широким спектром антибактериальной активности и клинической эффективности, бактериофаги эффективны против лекарственно-устойчивых организмов, что предоставляет возможность расценивать их как аналоги или заменители антибиотиков и средства противосептической терапии.
Фаготерапия может использоваться профилактически с целью борьбы с распространением инфекционного заболевания там, где источник идентифицирован на ранней стадии, или там, где вспышки случаются внутри сравнительно закрытых организаций, таких как школы или детские сады.
Активность лечебно-профилактических бактериофагов при инфекционных болезнях пищеварительной системы, гнойно-септических заболеваниях кожных покровов, кровеносной системы, дыхательной системы, опорно-двигательного аппарата, мочеполовой системы (более 180 нозологических единиц заболеваний, вызванных бактериями Klebsiella, Escherichiae, Proteus, Pseudomonas, Staphylococcus, Streptococcus, Serratia, Enterobacter) довольно высока – от 72 до 90% – и часто является единственным эффективным лечебным средством. Также это касается штаммов больничного происхождения, характеризующихся множественной устойчивостью к антибиотикам.
Препараты бактериофагов
Лечебно-профилактические препараты бактериофагов составлены из поликлональных патогенных бактериофагов обширной сферы действия, действенных относительно антибиотикоустойчивых бактерий. По составу различают поливалентные (активные по отношению к различным видам и сероварам одного возбудителя) и комбинированные (с содержанием фагов к нескольким возбудителям) бактериофаги, что позволяет получить лечебный эффект при наличии микробных ассоциаций. ФГУП «НПО «Микроген» Минздрава России выпускает большой спектр лекарственных бактериофагов: стафилококковый, стрептококковый, коли, протейный, синегнойный, клебсиеллезный, брюшнотифозный, дизентерийный, сальмонеллезный. Имеются и их комбинированные формы: колипротейный бактериофаг, интести бактериофаг (смесь стерильных фильтратов фаголизатов бактерий: Shigella Flexneri 1-6 серогруппы В, Sonnei серогруппы D; Salmonella paratyphi A,B, Typhimurium, Choleraesuis, Oranienburg, Enteritidis, наиболее распространенных серологических групп E. coli – 0111, 055, 026, 125, 0119, 0128, 018, 044, 025, 020, Proteus (vulgaris, mirabilis), Staphylococcus, Pseudomonas, Enterococcus – титр фага не менее 1 х 106).
Препараты бактериофагов представляют собой стерильный фильтрат бактериальных фаголизатов, их прописывают для применения внутрь, местно для орошения повреждений и слизистых, введения в полости матки, мочевого пузыря, уха, придаточных пазух, а также в дренированные полости – брюшную, плевральную, а также в полости нарывов и гнойников после удаления экссудата. Бактериофаги способны стремительно проникать в кровоток, лимфатическую систему, а удаляются из организма вместе с мочой. Соответствие препаратов бактериофагов нынешней атиологической структуре возбудителей достигается производством штаммов, или штаммов-продуцентов, или синтезированного материала, не подлежащего каким-либо трансформациям. Такая пластичность бактериофаговых препаратов обеспечивает продолжительный эффект первичной фагоустойчивости возбудителей. Применение бактериофагов для лечения инфекционных заболеваний инициирует факторы специфического и неспецифического иммунитета, что в особенности результативно для терапии длительных инфекционных заболеваний, возникших в результате ослабления иммунитета на фоне депрессивного расстройства при бактерионосительстве. Научными исследованиями, во время клинических наблюдений, методом эксперимента выявлена несостоятельность плазмид передавать антибиотикам иммунитет к токсигенности профилактико-терапевтическим препаратам бактерионосительства, потому что они являются поликлональными комплексами вирулентных бактериофагов.
При использовании бактериофагов в крупных клиниках целесообразно включать в состав производственных штаммов, на которых готовятся коммерческие препараты, госпитальные штаммы возбудителей гнойно-воспалительных заболеваний, характерных для данного стационара. Отечественными неонатологами показана высокая эффективность фаготерапии гнойно-септических инфекций у детей раннего возраста. Помимо литического действия на микробы, отмечают их значение в механизме антитоксического, клеточного и гуморального иммунитета. Изучение возможности применения бактериофагов как альтернативы антибиотикотерапии для лечения острой кишечной инфекции (ОКИ) у детей в возрасте до 3 лет, проводимое на кафедре детских инфекционных болезней КНМУ, показало высокую эффективность поливалентного Интести-бактериофага. Был сделан вывод о возможности проведения этиотропной терапии поливалентным Интести-бактериофагом без включения антибиотиков больным ОКИ в легкой и средне-тяжелой форме даже в условиях общего кишечного отделения.
Дисбиоз как актуальная проблема у детей
В последние годы актуальной задачей в педиатрии остается рациональная фармакотерапия дисбиозов различного генеза. В особенности актуальна проблема дисбиоза кишечника у детей раннего возраста. Результаты современных исследований свидетельствуют о наличии дисбактериоза кишечника I-II степени у 50% здоровых детей грудного возраста, III-IV степени - у 20-25% детей. Нарушения микробиоценоза кишечника наблюдают практически при всех заболеваниях детского возраста. При формировании дисбактериоза усугубляется общее состояние пациента, снижается резистентность организма к инфекционным и антигенным агентам, толерантность к пищевым продуктам. Все это создает фон для более тяжелого течения заболеваний, возникновения осложнений, перехода острых форм в хронические. Дети первого полугода жизни особенно подвержены дисбиозу, что обусловлено транзиторной недостаточностью ферментов (в основном лактазы), незрелостью вегетативной нервной системы (ВНС), регулирующей моторику кишечника, несформированностью иммунных механизмов.
Основными причинами возникновения дисбиоза кишечника в детском возрасте являются:
Несвоевременное начало и неправильное ведение лактации;
ранний переход и нерациональное искусственное вскармливание на первом году жизни ребенка и нарушение режима питания в старшем возрасте;
острые кишечные инфекции и заболевания пищеварительного канала неинфекционного характера;
нерациональное применение антибиотиков и других химиотерапевтических препаратов;
аллергическая предрасположенность;
снижение естественной резистентности организма.
Лечение пациентов с дисбиозом кишечника следует проводить дифференцированно и начинать с выявления основного заболевания, без лечения которого признаки дисбиоза рецидивируют. Длительность одного курса лечения детей индивидуальна и колеблется от 10 сут. до 1,52 мес. Повторные курсы проводят после промежуточного бактериологического контроля (исследование кала) не ранее, чем через 2 нед. после окончания курса терапии. Суммарная длительность восстановления (до уровня устойчивой клинической компенсации) зависит от многих сопутствующих факторов и составляет 69 мес.
В современной детской гастроэнтерологии используется широкий арсенал препаратов для коррекции нарушенного микробиоценоза кишечника. В клинической практике педиатры и гастроэнтерологи для коррекции дисбиоза всe чаще используют бактериофаги. Применяют коли-протейный, стафилококковый, синегнойный, поливалентный дизентерийный, сальмонеллезный, комбинированный (смесь стафилококкового, стрептококкового, коли, синегнойного, протейного бактериофагов), поливалентный пиобактериофаг, интестифаг и др. Применение специфических бактериофагов позволяет оптимальным образом осуществить селективную деконтаминацию, проводимую при ряде патологических состояний с целью санирующего эффекта, а также для восстановления нормального микробиоценоза. Являясь безвредным биологическим методом лечения, бактериофаготерапия может применяться у детей раннего возраста. Для получения положительных результатов использования бактериофагов необходимо предварительное исследование чувствительности к ним микроорганизмов.
Коли-протейный бактериофаг жидкий мы применяем при лечении детей с дисбиозом, обусловленным энтеропатогенной кишечной палочкой (эшерихией) и протеем (мирабилис или вульгарным). Бактериофаг назначаем внутрь или в клизме. Суточная доза препарата для применения внутрь: детям в возрасте до 6 мес. 5 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме вместо одного из приемов через рот; от 6 мес. до 1 года 1015 мл 2 раза в сутки внутрь и 20 мл 1 раз в сутки в клизме; в возрасте 13 лет 1520 мл 2 раза в сутки внутрь и 40 мл 1 раз в сутки в клизме; старше 3 лет 20 мл 2 -3 раза в сутки внутрь и 40-60 мл 1 раз в сутки в клизме. Внутрь бактериофаг назначают за 1-1,5 ч до еды. Детям первого месяца жизни бактериофаг разводят кипяченой водой в 2 раза. Детям старше 6 мес. за 5-10 мин до введения препарата дают 10-20 мл (в зависимости от возраста) 2-3%-ного раствора натрия гидрокарбоната для нейтрализации желудочного сока. Курс лечения составляет 5-10 сут. в зависимости от степени выраженности дисбиотических нарушений.
В клизме препарат целесообразно применять при отсутствии синдрома мальабсорбции: детям до 6 мес. - 20 мл, от 6 мес. до 3 лет - 30-40 мл, старше 3 лет - 40–50 мл. Препарат вводят 1 раз в сутки 23 курсами продолжительностью 3-4 сут. С интервалом между курсами 3 сут. Противопоказаний к применению препарата нет. Назначение бактериофага не исключает применения других ЛС.
Стафилококковый бактериофаг жидкий мы назначаем внутрь в суточной дозе: детям до 6 мес. - 20 мл, 6 мес. - 3 года - 40 мл, старше 3 лет - 100 мл. Вводят в 2 приема, натощак, за 1,5-2 ч до еды. В клизме в этих же дозах следует вводить 1 раз в сутки по той же схеме.
Поскольку мы в реальной клинической практике при дисбиозах встречаемся с одновременным ростом различных представителей патогенной микрофлоры, важно назначение в подобных случаях с учетом данных бактериологических исследований комбинированных бактериофагов - смеси стафилококкового, стрептококкового, коли, синегнойного, протейного бактериофагов. Их назначают детям в возрасте до 3 лет по 3-5 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме; старше 3 лет - 5-10 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме. Внутрь назначают за 1 ч до еды. Возможно дополнительное введение комбинированного фага в высокой клизме по 5-20 мл. Курс лечения 5-15 сут.
Интестифаг содержит фаголизаты кишечной палочки, шигеллезы сальмонелл, УПМ. Назначают внутрь за 1 ч до еды детям в возрасте до 3 лет по 3-5 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме; детям старше 3 лет - по 5-10 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме. Курс лечения 5-6 сут.
Поливалентный пиобактериофаг, или секстифаг - смесь фаголизатов кишечной палочки, клебсиеллы, синегнойной палочки, стафилококка, стрептококка, протея. Данный препарат отличается наиболее высокой степенью очистки от бактериальных метаболитов, что значительно улучшает его вкусовые качества и делает средством первого выбора у детей до года. Назначают: детям в возрасте до 3 лет - 3-5 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме; старше 3 лет - 5-10 мл 3 раза в сутки внутрь и 10 мл 1 раз в сутки в клизме. Внутрь применяют за 1 ч до еды. Курс лечения 5-15 сут.
Применение фагов предшествует назначению кислотообразующих препаратов (пребиотиков, пробиотиков и др.).
Заключение
Препараты бактериофагов эффективны при лечении болезней, вызванных антибиотикоустойчивыми штаммами микроорганизмов, в частности при лечении паратонзиллярных гнойников, воспалений пазух носа, а также гнойно-септических инфекций, реанимационных больных, хирургических заболеваний, циститов, пиелонефритов, холециститов, гастроэнтероколитов, дисбактериоза кишечника, воспалительных заболеваний и сепсиса новорожденных. При обширно распространенном формировании стабильности к антибиотикам у патогенных бактерий необходимость в новых антибиотиках и альтернативных технологиях контроля за микробными инфекциями завоевывает все большую значимость. Бактериофагам, вероятно, еще предстоит исполнить свою роль в лечении инфекционных заболеваний как при их независимом применении, так и в сочетании с антибиотико-терапией.
Литература
1. Антибиотики-убийцы: [история открытия, польза и вред, противопоказания, ищем замену, когда нет выхода]. М.: Эксмо, 2007.
2. Приворотский В.Ф., Лупова Н.Е., Шильникова О.В. Логика построения корригирующих медикаментозных программ нарушенного микробиоценоза кишечника у детей // РМЖ. 2007. №1. С. 6–9.
3. Бельмер С.В. Антибиотик-ассоциированный дисбактериоз кишечника // РМЖ. 2004. Т. 12. №3. С. 148–151.
4. Методы нормализации пищеварения у детей с дисбактериозом: пособие для врачей / под ред. академика РАМН А.А. Баранова. М., 2005. С. 38–39.
5. Заболевания кишечника. Справочник для практических врачей «Ремедиум-врач». М.: ООО «Издательство «Ремедиум». С. 74–76.
6. Государственный реестр лекарственных средств. М.: МЗиСР (интернет версия www.drugreg.ru) .
7. Нижевич А.А., Хасанов Р.Ш., Нуртдинова Н.М., Очилова Р.А., Логиновская В.В., Калметьева Л.Р. Антибиотик-ассоциированный дисбактериоз кишечника у детей // РМЖ. 2007. №1. С. 12–15.
8. Щербаков П.Л., Цветков П.М., Нечаева Л.В. Профилактика диареи, связанной с приемом антибиотиков у детей // Вопросы современной педиатрии. 2004. Т. 3. №2.
9. Корман Д.Б. Основы противоопухолевой химиотерапии. М.: Практическая медицина, 2006.
10. Зеленин К.Н. Возникновение и развитие химиотерапии.
11. Урсова Н.И. Дисбактериоз кишечника у детей: руководство для практических врачей / под ред. Г.В. Римарчук. М.: «Компания БОРГЕС», 2006.
12. Ларчини Д., Паренти Ф. Антибиотики / пер. с англ. Ю.В. Дудника. М.: Мир, 1985.
13. Клинико-иммунологическая эффективность иммунобиологических препаратов / под ред. М.П. Костинова и И.В. Медуницына. М.: Миклош, 2004. С. 195–206.
14. Стент Г. Молекулярная биология вирусов бактерий / пер. с англ. М., 1965.
15. Хейс У. Генетика бактерий и бактериофагов / пер. с англ. М., 1965.
16. Шлегель Г. Общая микробиология / пер. с нем. М., 1987. С. 142.
Бактериофаги
Бактериофагами называют вирусы, живущие в бактериях.
Бактериофаги (от бактерии и греч. phagos — пожиратель; буквально — пожиратели бактерий), фаги, бактериальные вирусы, вызывающие разрушение (лизис) бактерий и других микроорганизмов. Бактериофаги размножаются в клетках, лизируют их и переходят в др., как правило, молодые, растущие клетки. Впервые перевиваемый лизис бактерий (сибиреязвенной палочки) наблюдал в 1898 русский микробиолог Н. Ф. Гамалея. В 1915 английский учёный Ф. Туорт описал это же явление у гнойного стафилококка, а в 1917 французский учёный Ф. Д"Эрелль назвал литический агент, проходящий через бактериальные фильтры.
Строение и химический состав. Частицы многих бактериофагов состоят из головки округлой, гексагональной или палочковидной формы диаметром 45—140 нм и отростка толщиной 10—40 и длиной 100—200 нм. Другие бактериофаги не имеют отростка; одни из них округлы, другие — нитевидны, размером 8х800 нм. Содержимое головки состоит преимущественно из дезоксирибонуклеиновой кислоты (ДНК) (длина её нити во много раз превышает размер головки и достигает 60—70 мкм, эта нить плотно скручена в головке) или рибонуклеиновой кислоты (РНК) и небольшого количества (около 3%) белка и некоторых других веществ. Отросток имеет вид полой трубки, окруженной чехлом, содержащим сократительные белки, подобные мышечным. У ряда бактериофагов чехол способен сокращаться, обнажая часть стержня. На конце отростка у многих бактериофагов имеется базальная пластинка с несколькими шиловидными или другие формы выступами. От пластинки отходят тонкие длинные нити, которые способствуют прикреплению фага к бактерии. Оболочки головки и отростка состоят из белков. Общее количество белка в частице фага 50—60% , нуклеиновых кислот — 40—50% . Каждый бактериофаг обладает специфическими антигенными свойствами, отличными от антигенов бактерии-хозяина и других фагов. Имеются антигены, общие для ряда фагов (особенно содержащих РНК).
Распространение. Бактериофаги найдены для большинства бактерий, в том числе патогенных и сапрофитных, а также.для актиномицетов (актинофаги) и сине-зелёных водорослей. Встречаются бактериофаги в кишечнике человека и животных, в растениях, почве, водоёмах, сточных водах, навозе и т. д. Бактериофаги почвенных микроорганизмов влияют на течение микробиологических процессов в почве.
Размножение. Бактериофаг прикрепляется своим отростком к бактериальной клетке и, выделяя фермент, растворяет клеточную стенку; затем содержимое его головки через канадец отростка переходит внутрь клетки, где под влиянием нуклеиновой кислоты фага останавливается синтез бактериальных белков, ДНК и РНК и начинается синтез нуклеиновой кислоты, а затем и белков фага. Часть этих белков — ферменты, другая часть образует оболочку зрелой частицы бактериофага Более мелкие, сферические фаги попадают в бактерии без участия отростка. Если клетка бактерии заражена одновременно частицами бактериофага, различающимися между собой по ряду свойств, то среди потомства, кроме частиц, подобных родителям, будут и такие, у которых эти свойства встречаются в новой комбинации, т. к. при размножении бактериофагов наблюдается
рекомбинация — обмен кусками нитей нуклеиновой кислоты, являющейся носителем наследственной информации. Частицы крупных фагов выходят из бактерии, разрушая её, а некоторых мелких и нитевидных — из живых бактерий. Одни бактериофаги весьма специфичны и способны лизировать клетки только одного какого-либо вида микроорганизмов (монофаги), другие — клетки разных видов (полифаги).
Бактериофагов делят на вирулентные, вызывающие лизис клетки с образованием новых частиц, и умеренные (симбиотические), которые адсорбируются клеткой и проникают в неё, но лизиса не вызывают, а остаются в клетке в латентной (скрытой) неинфекционной форме (профаг). Культуры, содержащие латентный фаг, называются лизогенными. Лизогения передаётся потомству бактерии. Лизогенная культура может содержать 2—3 и более фагов; она, как правило, устойчива против находящихся в ней фагов (лишь небольшая часть клеток лизируется и освобождает зрелые фаги). Воздействуя на лизогенную культуру ультрафиолетовыми или рентгеновскими лучами, перекисью водорода и некоторыми другими веществами, можно значительно увеличить количество клеток, освобождающих фаг (т. н. индукция бактериофагов). Лизогения широко распространена среди всех видов бактерий и актиномицетов. В ряде случаев многие свойства лизогенной культуры (токсичность, подвижность бактерий и др.) зависят от наличия в ней определённых профагов. Описано много мутаций бактериофагов, сопровождающихся изменением их литической активности, строения частиц и «колоний», устойчивости против неблагоприятных воздействий и другие свойств. Бактериофаги играют большую роль в изменчивости и эволюции микробов, причём механизмы воздействия их на клетку разные. Бактериофаги могут резко изменять азотфиксирующую способность азотобактера, токсичность и антигенные свойства патогенных бактерий и др.
Практическое значение бактериофагов Некоторые фаги (одни или в сочетании с антибиотиками) применяли для профилактики (фагопрофилактики) и лечения (фаготерапии) ряда бактериальных инфекционных болезней человека (дизентерия, брюшной тиф, холера, чума, стафилококковые и анаэробная инфекции и др.) и животных. Однако антибиотики и другие химиотерапевтические средства оказались эффективнее фагов, в связи с чем применение их с лечебной целью сузилось. Бактериофаги успешно применяются при определении вида бактерий, актиномицетов. Бактериофаги могут вредить производству антибиотиков, аминокислот, молочных продуктов, бактериальных удобрений и в других отраслях микробиологического синтеза. Велико значение бактериофагов для теоретических работ по генетике и молекулярной биологии.
Бактериофаги или фаги (от др.-греч. φᾰγω – «пожираю») – вирусы, избирательно поражающие бактериальные клетки. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их лизис. Как правило, бактериофаг состоит из белковой оболочки и генетического материала.
История
Английский бактериолог Фредерик Туорт в статье 1915 года описал инфекционную болезнь стафилококков, инфицирующий агент проходил через фильтры, и его можно было переносить от одной колонии к другой. Независимо от Фредерика Туорта французско-канадский микробиолог Феликс Д’Эрелль 3 сентября 1917 года сообщил об открытии бактериофагов. Наряду с этим известно, что российский микробиолог Николай Фёдорович Гамалея ещё в 1897 году впервые наблюдал явление лизиса бактерий (сибиреязвенной палочки) под влиянием перевиваемого агента.
Бактериофаги незримо присутствуют повсюду в нашем мире – в океане, почве, глубоководных источниках, питьевой воде и пище. Они – наиболее представленная форма жизни на Земле – от 10 30 до 10 32 фаговых частиц в биосфере, – и играют ключевую роль в поддержании баланса всех исследованных экосистем. Бактериофаги являются естественными регуляторами и борцами с бактериями и обеспечивают динамическое равновесие в природе, сохраняя относительное постоянство микробного пейзажа в природе и ограничивая рост популяции бактерий. Бактериофаги присутствуют даже в нашей пище – ежедневное поедание бактериофагов с пищей, в которой они присутствуют естественным образом, регулирует микробный баланс в организме человека.
Знаменитый ученый Д, Эрелль представил миру бактериофаги как естественные антибактериальные агенты и предложил использовать их для терапии – еще до открытия антибиотиков.

Классификация
Различают две группы бактериофагов: умеренные и вирулентные. Умеренные фаги медленно размножаются внутри пораженной бактериальной клетки, передаются внутри бактериальной колонии из поколения в поколение, периодически разрушая микробные клетки. Такой эффект называется лизогенным. Вирулентные фаги, попав в клетку микроба начинают стремительно размножаться, приводя к быстрой гибели зараженной клетки. Такой эффект называется литическим.
Какие проблемы решают препараты бактериофагов?
1.Эффективная борьба с бактериальными инфекциями
Позволяют эффективно бороться с бактериальными инфекциями без риска развития осложнений на печень, почки и другие жизненно важные органы, подвергающиеся повреждающему действию обычных антибактериальных средств.
2.Усиление действия антибиотиков
При совместном применении с антибиотиком могут усиливать эффективность последнего.
3.Уничтожают только вредоносные бактерии
Уничтожают вредоносные бактерии и сохраняют собственные, «полезные» для нас бактерии (кишечную микрофлору, микрофлору половых органов), не вызывая дисбактериоз.
4.Эффективная замена антибиотикам
При отсутствии эффекта от применения антибиотиков (при устойчивости бактерий к антибиотикам) и наличии хронической, рецидивирующей инфекции, бактериофаги являются отличным выбором в качестве препаратов антибактериальной терапии.
5. Минимум противопоказаний
При наличии противопоказаний к применению антибиотиков (при антибиотико ассоциированных диареях, нарушении работы печени и почек и др.) – бактериофаги незаменимы.
6. Бактериофаги могут применяться как внутрь, так и использоваться для наружного применения
Бактериофаги могут применяться как внутрь, так и использоваться для наружного применения, что решает проблему не только на уровне всего организма, но и местно в месте локализации инфекции.
Механизм действия бактериофагов

Вирус проникает в клетку патогенной бактерии, внедряется в ее геном и начинает размножаться. После накопления внутри бактериальной клетки определенного количества новых вирусных частиц (вирионов) клетка разрушается, вирусы выходят наружу и заражают новые бактериальные клетки.
Жизненный цикл бактериофага
- Фаг приближается к бактерии, и хвостовые нити связываются с рецепторными участками на поверхности бактериальной клетки.
- Хвостовые нити изгибаются и «заякоривают» шипы и базальную пластинку на поверхности клетки; хвостовой чехол сокращается, заставляя полый стержень входить в клетку; этому способствует фермент лизоцим, который находится в базальной пластинке; таким образом, нуклеиновая кислота (ДНК или РНК) вводится внутрь клетки.
- Нуклеиновая кислота фага кодирует синтез ферментов фага, используя для этого белоксинтезирующий аппарат хозяина.
- Фаг тем или иным способом инактивирует ДНК и РНК хозяина, а ферменты фага совсем расщепляют её; РНК фага подчиняет себе клеточный аппарат.
- Нуклеиновая кислота фага реплицируется и кодирует синтез новых белков оболочки.
- Новые частицы фага, образовавшиеся в результате спонтаной самосборки белковой оболочки вокруг фаговой нуклеиновой кислоты; под контролем РНК фага синтезируется лизоцим.
- Лизис клетки: клетка лопается под воздействием лизоцима; высвобождается около 200-1000 новых фагов; фаги инфицируют другие бактерии.
- Стадии 1-7 по времени занимают около 30 минут; этот период называется латентным периодом.
Две стороны медали
Достоинства
Бактерии теряют чувствительность к действию антибиотиков. Фармацевтическая промышленность неустанно синтезирует другие. Однако известно, что возможности синтеза антибиотиков ограничены. К действию бактериофагов антибиотики приспосабливаются очень тяжело, а, как утверждают специалисты, к комплексу из нескольких бактериофагов микробы не могут выработать резистентность и вовсе. Кроме того, бактериофаги практически не имеют побочного действия, реже вызывают аллергические явления, могут сочетаться с любыми препаратами. Бактериофаги в настоящий момент хорошо зарекомендовали себя при лечении урологических заболеваний, гнойных процессов в хирургии, а также при лечении инфекционных заболеваний кишечника у новорожденных детей.
Недостатки
- К сожалению, недостатков у медицинских бактериофагов тоже немало. Самая главная проблема проистекает из достоинства – высокой специфичности фагов. Каждый бактериофаг инфицирует строго определенный тип бактерий, даже не таксономический вид, а ряд более узких разновидностей, штаммов. Условно говоря, как если бы сторожевая собака начинала лаять только на одетых в черные плащи громил двухметрового роста, а на лезущего в дом подростка в шортах никак не реагировала. Поэтому для нынешних фаговых препаратов нередки случаи неэффективного применения. Препарат, сделанный против определенного набора штаммов и прекрасно лечащий стрептококковую ангину в Смоленске, может оказаться бессильным против по всем признакам такой же ангины в Кемерове. Болезнь та же, вызывается тем же микробом, а штаммы стрептококка в разных регионах оказываются различными.
Для максимально эффективного применения бактериофага необходима точная диагностика патогенного микроба, вплоть до штамма. Самый распространенный сейчас метод диагностики – культуральный посев – занимает много времени и требуемой точности не дает. Быстрые методы – типирование с помощью полимеразной цепной реакции или масс-спектрометрии – внедряются медленно из-за дороговизны аппаратуры и более высоких требований к квалификации лаборантов. В идеале подбор фагов-компонентов лекарственного препарата можно было бы делать против инфекции каждого конкретного пациента, но это дорого и на практике неприемлемо.
- Другой важный недостаток фагов – их биологическая природа. Кроме того, что бактериофаги для поддержания инфекционности требуют особых условий хранения и транспортировки, такой метод лечения открывает простор для множества спекуляций на тему «посторонней ДНК в человеке». И хотя известно, что бактериофаг в принципе не может заразить человеческую клетку и внедрить в нее свою ДНК, поменять общественное мнение непросто.
- Из биологической природы и довольно большого, по сравнению с низкомолекулярными лекарствами (теми же антибиотиками), размера вытекает третье ограничение – проблема доставки бактериофага в организм. Если микробная инфекция развивается там, куда бактериофаг можно приложить напрямую в виде капель, спрея или клизмы, – на коже, открытых ранах, ожогах, слизистых оболочках носоглотки, ушей, глаз, толстого кишечника – то проблем не возникает.
- Но если заражение происходит во внутренних органах, ситуация сложнее. Случаи успешного излечения инфекций почек или селезенки при обычном пероральном приеме препарата бактериофага известны. Но сам механизм проникновения относительно крупных (100 нм) фаговых частиц из желудка в кровоток и во внутренние органы изучен плохо и сильно разнится от пациента к пациенту. Бактериофаги бессильны и против тех микробов, которые развиваются внутри клеток, например возбудителей туберкулеза и проказы. Через стенку человеческой клетки бактериофаг пробраться не может.
Нужно отметить, что противопоставлять применение бактериофагов и антибиотиков в медицинских целях не следует. При совместном их действии наблюдается взаимное усиление противобактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Соответственно, и механизм выработки у бактерий устойчивости к обоим компонентам комбинированного лекарства почти невозможен.
Расширение арсенала противомикробных препаратов дает больше степеней свободы в выборе методики лечения. Таким образом, научно обоснованное развитие концепции применения бактериофагов в противомикробной терапии – перспективное направление. Бактериофаги служат не столько альтернативой, сколько дополнением и усилением в борьбе с инфекциями.

Применение
В медицине
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие. В настоящее время их применяют для лечения бактериальных инфекций, которые не чувствительны к традиционному лечению антибиотиками, особенно в республике Грузия. Обычно, применение бактериофагов сопровождается большим, чем антибиотики, успехом там, где присутствуют биологические мембраны, покрытые полисахаридами, через которые антибиотики обычно не проникают. В настоящее время терапевтическое применение бактериофагов не получило одобрения на Западе, хотя и применяются фаги для уничтожения бактерий, вызывающих пищевые отравления, таких, как листерии. В многолетнем опыте в объёме крупного города и сельской местности доказана необычайно высокая лечебная и профилактическая эффективность дизентерийного бактериофага.
В биологии
Бактериофаги применяются в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
Фаговые векторы обычно создают на базе умеренного бактериофага λ, содержащего двухцепочечную линейную молекулу ДНК. Левое и правое плечи фага имеют все гены, необходимые для литического цикла (репликации, размножения). Средняя часть генома бактериофага λ (содержит гены, контролирующие лизогению, то есть его интеграцию в ДНК бактериальной клетки) не существенна для его размножения и составляет примерно 25 тысяч пар нуклеотидов. Данная часть может быть заменена на чужеродный фрагмент ДНК. Такие модифицированные фаги проходят литический цикл, но лизогения не происходит. Векторы на основе бактериофага λ используют для клонирования фрагментов ДНК эукариот (то есть более крупных генов) размером до 23 тысяч пар нуклеотидов (т. п. н.). Причём, фаги без вставок – менее 38 т. п. н. или, напротив, со слишком большими вставками – более 52 т. п. н. не развиваются и не поражают бактерии.
Поскольку размножение бактериофага возможно только в живых клетках, бактериофаги могут быть использованы для определения жизнеспособности бактерий. Данное направление имеет большие перспективы, поскольку, одним из основных вопросов при разных биотехнологических процессах является определение жизнеспособности используемых культур. С помощью метода электрооптического анализа клеточных суспензий была показана возможность изучения этапов взаимодействия фаг-микробная клетка.
Добрый день, дорогие читатели! Многие из нас проходили курс антибактериальной терапии хоть раз в жизни. Однако в большинстве случаев речь шла об антибиотиках. С бактериофагами приходилось сталкиваться не всем. В то же время медики склонны говорить о том, что сегодня эти медикаменты могут стать хорошей альтернативой. Бактериофаги, виды и назначение этих уникальных по своей природе препаратов мы и рассмотрим.
Бактериофаг: что это за лекарство?
История возникновения
История бактериофагов насчитывает около 100 лет. В 1915 -1917 годах их открытие состоялось почти одновременно во Франции, Англии и России, где три биолога, независимо друг от друга, наблюдали явление лизиса бактерий.
После изучения свойств микроскопических вирусом ученый Феликс Д"Эрелль высказал мысль о том, что они играют большую роль в процессе выздоровления организма, пораженного бактериальной инфекцией. С тех пор возникло усиленное внимание к фагам, началось их стремительное изучение.
Строение фага
Фаги не продукт генной инженерии. Они встречаются и в природе, в тех местах, где есть чувствительные к ним бактерии. Строение вируса напоминает головастика: в нем есть хвостик и головка. В последней заложен генетический материал. В состав фага входит белковая оболочка и нуклеиновые кислоты, из которых складывается ДНК.
Особенности каждого бактериофага зависят от того, против каких бактерий он направлен. Замечены случаи, когда вирусы не могут воздействовать даже на бактерии своего класса, поскольку некоторые особи оказываются резистентными к бактериофагам. Чтобы лечиться этими медикаментами, нужно быть точно уверенными в диагнозе: на другие бактерии и микроорганизмы вирусы не действуют.
Как используют?
Довольно часто фаги используют в комплексной антибактериальной терапии. Им отдается преимущество, если нет смертельной угрозы для пациента. В отличие от антибиотиков, «сметающих» все на своем пути, медикаменты с минивирусами не убивают полезную микрофлору, действуют избирательно и безболезненно выводятся из организма.
Их совместимость с любыми лекарствами 100%-ная, поскольку они не вступают в реакцию с другими химическими веществами и не вызывают осложнений. Единственным исключением является прием лекарств, включающих бактерии, например, Линекс, Аципол, Бифидум-бактерин.
Тем не менее, в рамках экстренной терапии фаги пока не могут заменить антибиотики, так как не всегда есть возможность точно установить возбудителя. Многие фаги можно давать детям даже в грудном возрасте, когда большинство антибиотиков запрещены. В детской терапии медикаменты на основе вирусных агентов более предпочтительны, так как имеют меньший объем побочных эффектов.
Виды бактериофагов
В современной медицине бактериофаги используют во многих сферах:
- гастроэнтерологии;
- отоларингологии;
- хирургии;
- гинекологии;
- урологии;
- пульмонологии.
Выбор конкретного медикамента зависит от заболевания и его возбудителя.
Каждый фаг может быть направлен только против конкретной бактерии, причем имеет место территориальная избирательность. Это означает, что бактерии и вирусы поддаются мутациям в зависимости от территории, на которой они находятся.
Классификация фагов осуществляется по возбудителям. При наличии одной инфекции используют:
Стафилококковый бактериофаг
Действует только против стафилококка, охватывая различные его виды, включая золотистый.
Интести
Эффективен против нескольких видов бактерий: кишечная палочка, энтерококк, стафилококк, синегнойная палочка, протей.
Поливалентный
Действует против кишечной палочки, синегнойной палочки, клебсиелл, протея.
Стрептококковый
Действует исключительно при стрептококковой моноинфекции.
Колипротейный
Применяется при комбинированных инфекциях, а именно: энтеропатогенной кишечной палочки, протеев, синегнойной палочки, стрептококков и стафилококков.
Сальмонеллезный

Бактериофаг против сальмонеллы.
Синегнойный
Действует эффективно против синегнойной палочки.
Коли
Действует против кишечной палочки. Существует колипротейный бактериофаг, эффективный против протеев.
Считается, что большей эффективностью обладают бактериофаги, действующие против одной инфекции. Медикаменты, сочетающие в себе несколько типов вирусов, помогают гораздо в меньшей степени. Бактериофаги выпускаются как в жидкой форме, так и таблетками. Если речь идет о лечении детей, то предпочтительной является жидкая форма выпуска.
Лечение бактериофагами
Назначение медикамента должен осуществлять только врач исключительно после анализов на выявление конкретной инфекции. Самостоятельное применение в домашних условиях может быть неэффективным, поскольку без специального исследования выявить возбудителя и определить его чувствительность к фагам нельзя.

Схема лечения каждой отдельно взятой инфекции разрабатывается для клиента индивидуально. Чаще всего к этим медикаментам прибегают для терапии кишечного дисбактериоза. Курс лечения в этом случае составляет около 5 дней, но в отдельных случаях может быть продлен до 15 суток. Для большей эффективности курсы повторяют 2-3 раза.
Вот пример одного из таких курсов терапии стафилококковой инфекции:
- грудничкам до полугода – по 5 мл;
- от полугода до года – по 10 мл;
- от года до трех лет дают 15 мл;
- от трех до восьми лет – 20 мл;
- после восьми лет – 30 мл.
Грудничкам можно давать фаги тремя способами:
- перорально (в рот);
- в форме клизмы;
- каплями в нос.
В возрасте после полугода третий вариант уже невозможен, поэтому назначают либо в виде клизмы, либо перорально. При этом дозировка для клизмы в среднем в два раза больше, чем объем, предписанный для приема через рот.
В отношении детей в педиатрии существуют различные отзывы медиков относительно применения бактериофагов. Одни утверждают, что минивирусы абсолютно безопасны, поэтому пока по старинке фаги назначают и младенцам.
В 2016 году появилась обновленная информация. Главный детский гастроэнтеролог Захарова И.Н. заявила о том, что терапия бактериофагами может привести к раку. Вирусы встраиваются в генную систему организма и могут разрушить ее.
Насколько справедливо такое утверждение, сложно сказать, но статус заявителя говорит о многом. Бактериофаги до конца еще не изучены, и применяться для терапии они стали сравнительно недавно. Длительных наблюдений за их действием на отдельные поколения пока нет.

Дорогие читатели, мы рассмотрели с вами действие бактериофагов на инфекции и организм человека. Если вам понравилась статья, рекомендуйте ее своим знакомым в соц. сетях. Информация дана для ознакомления.